
汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:
PbO2 (s)+Pb(s)+2H2SO4(aq)===2PbSO4(s)+2H2O(l),根据此反应判断下列叙述中正确的是( )
A. PbO2是电池的负极
B. 负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s)
C. 铅蓄电池属于一次电池
D. 电池放电时,溶液酸性增强
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放电时,电子从PbO2一极流入铅板 | B、放电时,负极的电极反应式为:Pb+SO2-4-2e-=PbSO4 | C、充电时,PbO2得到电子,被氧化 | D、放电时,溶液的酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
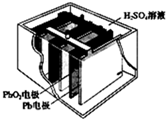 汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )| A、PbO2是电池的负极 | B、放电时,溶液中的H+向正极区移动,正极区域的溶液的酸性增强 | C、放电时,电子由Pb 极通过导线流向 PbO2 | D、正极的电极反应式为Pb-2e-=Pb2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com