
��12�֣���һ���¶��½�2 mol A��2 mol B������������ij2L�ܱ������У��������·�Ӧ��3A (g)��3B(g) 2C(g) ��2D(g)��2 min ĩ��Ӧ�ﵽƽ��״̬������0.8 mol D������д����հף�
2C(g) ��2D(g)��2 min ĩ��Ӧ�ﵽƽ��״̬������0.8 mol D������д����հף�
��1��B��ƽ��Ũ��Ϊ ��
��2��A��ת����Ϊ ��
��3����D��ʾ��ƽ����Ӧ����Ϊ ��
��4�������С��Ӧ�����ݻ����¶Ȳ��䣩��ʹѹǿ������ƽ����ϵ��C�����ʵ���Ũ�� ��C���������� ���������ƽ����Է������� �������������С�����䡱����
 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
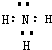
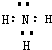
| ||
| ||
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-| 4 |
| 27 |
| 4 |
| 27 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
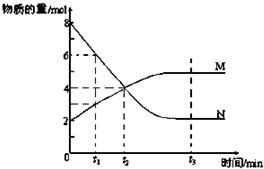
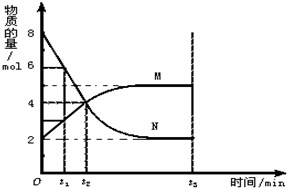 ��һ���¶��£����ݻ�Ϊ2L�������ڣ�ij��Ӧ�����ʣ���Ϊ���壩�����ʵ����淴Ӧʱ��ı仯������ͼ���Իش��������⣺
��һ���¶��£����ݻ�Ϊ2L�������ڣ�ij��Ӧ�����ʣ���Ϊ���壩�����ʵ����淴Ӧʱ��ı仯������ͼ���Իش��������⣺ M
M M
M�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| a |
| 72V |
| a |
| 72V |
| 2000m |
| MV |
| 2000m |
| MV |
| 100m |
| Vp |
| 100m |
| Vp |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
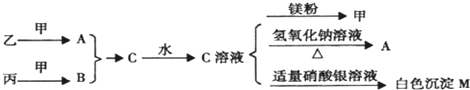
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��1��1mol O2������������Ӧ����ˮ��������483.6kJ����1gˮ����ת����Һ̬ˮ����2.444kJ����д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ��
��1��1mol O2������������Ӧ����ˮ��������483.6kJ����1gˮ����ת����Һ̬ˮ����2.444kJ����д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com