
| 方法 | 选用试剂 | 现象 |
| 第一种(萃取) | 氯水、四氯化碳 | 下层溶液显紫色 |
| 第二种 |
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:选择题
| A. | 两者生成硝酸铜的物质的量不同 | |
| B. | 浓硝酸产生的气体更少 | |
| C. | 稀硝酸被还原之后的生成物的价态更低,所以稀硝酸的氧化性更强 | |
| D. | 两个反应中的电子转移的数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
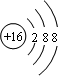
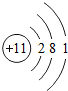 ;铝原子的结构示意图是
;铝原子的结构示意图是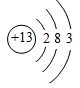 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应是吸热反应 | |
| B. | 化学反应中的能量变化只表现为热量变化 | |
| C. | 当反应物的总能量高于生成物的总能量时,通常发生放热反应 | |
| D. | 当反应物的总能量高于生成物的总能量时,通常发生吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;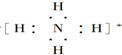 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 溶液 | 加入的物质 | 字母代号 |
| ①饱和石灰水 | 通过量CO2 | B |
| ②AlCl3溶液 | 通过量NH3 | C |
| ③MgCl2、AlCl3混合溶液 | 逐滴加NaOH溶液至过量 | A |
| ④AlCl3溶液 | 逐滴加NaOH溶液至过量 | E |
| ⑤含少量HCl的AlCl3溶液 | 逐滴加NaOH溶液至过量 | F |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com