



 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.O、Na、S的原子半径依次增大 | B.LiOH、KOH、CsOH的碱性依次增强 |
| C.HF、NH3、SiH4的稳定性依次增强 | D.HCl、HBr、HI的还原性依次减弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有x+1 | B.可能是x+1或x+11或x+25 |
| C.可能是x+8 | D.可能是x+2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 实验步骤 | 实验现象 | 实验依据和结论 |
 3mL1mol/L 3mL3mol/L 盐酸 盐酸 (金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.H2R2的分子中既含有极性共价键,又含有非极性共价键 |
| B.Q、R的简单氢化物分子所含质子数、电子数与Ne分子相同 |
| C.T的氧化物是一种良好的半导体材料 |
| D.Q的氢化物与W的氢化物反应有白烟现象,且生成物中既含有离子键,又含有共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | | ⑦ | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题


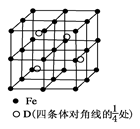
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.47 | B.57 | C.61 | D.175 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com