
����Ŀ��ij��ѧ��ȤС��ͬѧչ����Ư���������ƣ�NaClO2�����о���

��֪����NaClO2������Һ���¶ȵ���38��ʱ����������NaClO23H2O������38��ʱ����������NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaCl��
���������ȼ�������ˮ��
��1��װ��A��NaClO3��Na2SO3�Ʊ�ClO2���壬�����ʵ��������۱�ֵΪ____________����װ���в���Ũ���������ϡ�����ԭ����___________��
��2��װ��B�������� _____________��װ��C�з�ӦΪ���ȷ�Ӧ���ڲ��ı䷴Ӧ��Ũ�Ⱥ�����������£�Ϊ��ʹ��Ӧ�ڵ����½��У�ʵ���пɲ�ȡ�Ĵ�ʩ��________________��
��3��д��װ��C���������ӷ���ʽ______________��
��4����װ��C��Ӧ�����Һ��ø����NaClO2����IJ�������Ϊ����װ��C�е�Һ��ȡ���ڼ�ѹ��55�������������������ִ��������___________________(��ʵ�鲽��)������֪��NaClO2����������ˮ�����ܽ����Ҵ����л��ܼ�����
���𰸡� 2:1 ����ClO2��ˮ�е��ܽ� ��ֹ���� ��Cװ�üӱ�ˮԡ�������μ����� 2ClO2 +H2O2 +2OH��= 2ClO2��+ O2��+ 2H2O ��©���и��� 38�����ȹ������Ҵ�ϴ�� 2~3 �������� 60���������õ���Ʒ
��������������Ҫ������ڡ���Ư���������ƣ�NaClO2�����о���̽��ʵ������ۡ�
��1��װ��A��NaClO3��Na2SO3�Ʊ�ClO2���壬�ӻ��ϼ�����������ȿ�֪�����ʵ��������۱�ֵΪ2:1����װ���в���Ũ���������ϡ�����ԭ���Ǽ���ClO2��ˮ�е��ܽ���
��2��װ��B�������Ƿ�ֹ������װ��C�з�ӦΪ���ȷ�Ӧ���ڲ��ı䷴Ӧ��Ũ�Ⱥ�����������£�Ϊ��ʹ��Ӧ�ڵ����½��У�ʵ���пɲ�ȡ�Ĵ�ʩ�Ǹ�Cװ�üӱ�ˮԡ�������μ�������
��3��װ��C������Ӧ�����ӷ���ʽ��2ClO2 +H2O2 +2OH��= 2ClO2��+ O2��+ 2H2O��
��4����װ��C��Ӧ�����Һ��ø����NaClO2����IJ�������Ϊ����װ��C�е�Һ��ȡ���ڼ�ѹ��55�������������������ִ�����������¶ȸ���38�������³��ȹ��ˣ����Ҵ�ϴ��2��3�Σ����¶ȵ���60�������¸���õ���Ʒ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ֹʹ�ù�ҵ�ƾ������Ͼƣ�������Ϊ��ҵ�ƾ��г�����������ʹ���ж��� �� ��
A.����B.�״�C.��ȩD.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������������Ӧ���ɵĻ������У���������Ϊ1��1.9��ԭ�Ӹ�����Ϊ1��3������������ԭ������Ϊ
A. 27 B. 56 C. 23 D. 64
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ�ĵ��ʼ��仯�����ڴ��⼰���������ȷ�����;�dz��㷺��
I.��ҵ�Ͽ��Բ����Ȼ�ԭ���Ʊ�����þ(�е�1107�����۵�648.8��)�� ����ʽ̼��þ[4MgCO3��Mg(OH)2��5H2O]�ͽ�̿��һ��������ϣ�������չ�ʽ¯���� ������700������һ��ʱ�䣬Ȼ��������1450����Ӧ�Ƶ�þ(ͬʱ���ɿ�ȼ�����壩��
��1����̼��ԭ���Ʊ�����þ��Ҫ������ж����ڿ����н��У���ԭ����____________��
��2����ʽ̼��þ�ֽ���ͼ��ʾ��д����1450����Ӧ�Ƶ�þ�Ļ�ѧ����ʽ��_____________��

II.��ҵ����������MgH2��LiBH4��ɵ���ϵ�����⣨����ͼ��ʾ����

��3��д����������з�����Ӧ�Ļ�ѧ����ʽ��___________��
III.��ҵ��MgO��Һ�Ǹ��Ե���������������ѳ������е�SO2����Ҫ�����ķ�Ӧ�У� �� Mg(OH)2+ SO2=MgSO3+H2O �� MgSO3+SO2+H2O= Mg(HSO3)2 �� Mg(HSO3)2+ Mg(OH)2=2MgSO3+2H2O �� 2MgSO3+O2=2MgSO4
����ʱ��MgO������Ч�ʡ�pH��ʱ��Ĺ�ϵ����ͼ��ʾ��

��֪20��ʱ��H2SO3��K1=l.54��10-2��K2=1.02��10-7��25��ʱ��Ksp[MgSO3]= 3.86��10-3��Ksp(CaSO3)= 3.1��10-7��
��4�����������ʹ��ҺpH��С�������ķ�Ӧ��______________(����������ۻ��)��
��5��Լ9000s֮������Ч�ʿ�ʼ���ٽ��ͣ���ԭ����______________��
��6������������ͬʱ��þ���ƻ�����Ч����Һ����Ħ������������ͼ��ʾ��þ������Ч���ܱȸƻ������ɵ�MgSO4�������õ�ˮ�����⣬����Ϊ______________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.5 L 2 mol��L-1FeCl3��Һ��0.2 L 5 mol��L-1KCl��Һ�е�Cl�����ʵ���֮�ȣ�������
A. 6��5 B. 3��2 C. 15��2 D. 3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
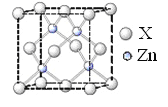
����Ŀ��A�������ʽṹ��������
����백�ڸ����·�Ӧ�õ���������

![]()
��1��Zn�Ļ�̬ԭ�Ӻ�������Ų�ʽΪ______________��
��2�������[Zn(NH3)3(H2O)]2���У���Zn2���γ���λ����ԭ����_____________(��Ԫ�ط���)��
��3��1 mol������к�����������ĿΪ_______________mol��
��4��������������̼ԭ�ӹ�����ӻ����������____________����NH3���ӻ�Ϊ�ȵ������������Ϊ_____________��
��5�����������۷е���ڼ��ԭ����____________��
��6��п��ij�ֻ����ᄃ���ṹ��ͼ��ʾ���ɸû�������������Ӹ�����Ϊ____________
B����ʵ�黯ѧ��
������(SO2Cl2)�������л���ѧ���Ȼ�������ҩ���Ⱦ�ϵ���ȡ��Ҳ����Ҫ���á�ij��ѧѧϰС�����ø����Cl2��SO2�ڻ���̿������ȡ�����ȡ���Ӧ�Ļ�ѧ����ʽΪ��SO2(g)+ Cl2(g) =SO2Cl2(l) ��H =97.3 kJ��mol1��ʵ��װ����ͼ��ʾ(���ּг�װ��δ����)��

��֪��������ͨ��������Ϊ��ɫҺ�壬�۵�54.1�����е�69.1�����ڳ�ʪ����������������100��C���Ͽ�ʼ�ֽ⣬���ɶ�����������������ڷ���Ҳ�ᷢ���ֽ⡣
�ش��������⣺
��1��װ�ñ���������������ˮ�������_____________(����a������b��)��װ�ü���������____________����ο������ַ�Ӧ�������ȣ�______________��
��2��װ�����Ϸ���Һ©�������ѡ�������Լ���_____________(ѡ����ĸ)��
A������ˮ B������ʳ��ˮ C��Ũ����������Һ D��6.0 molL1����
��3����ȱ��װ���ҺͶ�(��ʢ��Ũ����)����ʪ�����Ͷ�����������Ӧ�Ļ�ѧ����ʽ��_____________��
��4���Ȼ���(ClSO3H)���ȷֽ⣬Ҳ���Ƶ������ȣ�2ClSO3H![]() SO2Cl2 + H2SO4���������ֲ���ķ�����____________(ѡ����ĸ)��
SO2Cl2 + H2SO4���������ֲ���ķ�����____________(ѡ����ĸ)��
A���ؽᾧ B������ C������ D����ȡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����������Ҫ��Ӧ֮һΪ2SO2(g)+O2(g)![]() 2SO3(g)����Ӧ�����������ı仯��ͼ��ʾ��
2SO3(g)����Ӧ�����������ı仯��ͼ��ʾ��

��1����ͼ��֪�÷�Ӧ������ӦΪ______________(��������������������)��Ӧ��
��2����Ӧ��ϵ�м��������ͼ��E1__________(��������������С����������������ͬ),E3________________��
��3����֪��2H2S(g)+O2(g)==2S(s)+2H2O(g) ��H=-442.4kJmol-1��
S(s)+O2(g)==SO2(g) ��H=-297.0kJmol-1��
��H2S(g)��O2(g)��Ӧ����SO2(g)��H2O(g)���Ȼ�ѧ����ʽ��______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ϩ�ɱ����Ը��������Һ����ΪCO2������������ȥ�����л��е���ϩ���� �� ��
A.ͨ����������KMnO4��ҺB.ͨ����������ˮ
C.��һ��������ͨ��H2D.����ֱ��ȼ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com