

图1-3-25
①甲、乙、丙、丁均为前三周期元素的单质;
②在一定条件下甲与丙和甲与丁都按物质的量之比1∶3反应,分别生成X和Y,在产物中元素甲呈负价;
③在一定条件下乙与丙和乙与丁都按物质的量之比1∶2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:
(1)甲是__________,乙是__________;
(2)甲与丙反应生成X的化学方程式是______________________________;
(3)乙与丁反应生成W的化学方程式是______________________________。
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
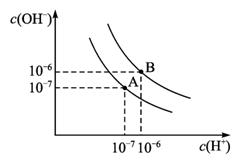
图1-2-13
(1)若A点表示25℃时水的电离平衡状态,当温度升高至100℃时水的电离平衡状态为B点,则此时水的离子积从_________增加到_________。
(2)将100℃ pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃恒温,欲使混合液的pH=7,则Ba(OH)2与盐酸的体积比为_________。
(3)向纯水中加入NaHSO4(温度不变)则溶液的_________。
A.pH升高 B.pH降低
C.c(H+)·c(OH-)增大 D.c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以上信息,完成下列各题:
(1)A和D氢化物中,沸点较低的是_________(选填“A”或“D”);A和B的离子中,半径较小的是_________ (填离子符号)。
(2)元素C在元素周期表中的位置是_________。
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图1-2-25所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)均位于小正方体中心。该化合物的电子式是_________。

图1-2-25
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)根据图1-4-25所示模型写出萨罗的结构简式:____________________________________。
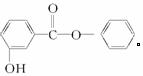
图1-4-25
(2)萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸)。请设计一个方案,说明苯酚、碳酸、水杨酸的酸性依次增强(用化学方程式表示)。
(3)同时符合下列四个要求的水杨酸的同分异构体共有__________种。
①含有苯环;
②能发生银镜反应,不能发生水解反应;
③在稀NaOH溶液中,1 mol该同分异构体能与2 mol NaOH发生反应;
④只能生成两种一氯代产物。
(4)从(3)确定的同分异构体中任选一种,指定为图1-4-26所示的框图中的A。
图1-4-26
写出下列两个反应的化学方程式(有机物用结构简式表示),并指出相应的反应类型。
①A→B
②B+D→E
(5)现有水杨酸和苯酚的混合物,它们的物质的量之和为n mol。该混合物完全燃烧消耗a L O2,并生成b g H2O和c L CO2(气体体积均为标准状况下的体积)。
①分别写出水杨酸和苯酚完全燃烧的化学方程式(有机物可用分子式表示)
②设混合物中水杨酸的物质的量为x mol,列出x的计算式。
查看答案和解析>>
科目:高中化学 来源: 题型:

图1-5-11
将17 g Na2CO3溶于80 mL水中,分装在C、D中,再将25 g铜屑放入圆底烧瓶中,将60 mL浓硫酸和10 mL水的混合液装在分液漏斗中,逐滴加入硫酸后,小心加热使SO2逐渐产生(注意控制气量大小和反应速率的快慢)。将SO2通入Na2CO3溶液中至饱和,在合并C、D两瓶所得的溶液中,慢慢加入17 g Na2CO3,蒸发浓缩,冷却后得亚硫酸钠晶体。试完成:
(1)如何配制60 mL浓硫酸与10 mL水的混合液?
答:_________________________________________________________________。
(2)装置B中浓硫酸的作用:____________________________________________________
_____________________________________________________________________。
(3)Na2CO3溶液要分装在C、D两瓶中的理由是______________,发生反应的离子方程式为_____________________________________________________________________。
(4)控制SO2产生速率的方法是___________________________________________________
_____________________________________________________________________。
(5)通SO2结束后,加Na2CO3的目的是___________________________________________
_____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com