
| A. | v(O2)=0.01 mol•L-1•s-1 | B. | v(NH3)=0.02mol•L-1•s-1 | ||
| C. | v(H2O)=0.06 mol•L-1•min-1 | D. | v(NO)=0.03mol•L-1•s-1 |
分析 在单位相同的条件下,化学反应速率与其计量数的比值越大,该反应速率越快,据此分析解答.
解答 解:A.$\frac{v({O}_{2})}{5}$=$\frac{0.01}{5}$mol•L-1•s-1=0.002mol•L-1•s-1=0.12mol•L-1•min-1,
B.$\frac{v(N{H}_{3})}{4}$=$\frac{0.02}{4}$mol•L-1•s-1=0.005mol•L-1•s-1=0.3mol•L-1•min-1;
C.$\frac{v({H}_{2}O)}{6}$=$\frac{0.06}{6}$mol•L-1•min-1=0.01mol•L-1•min-1;
D.$\frac{v(NO)}{4}$=$\frac{0.03}{4}$×60mol•L-1•min-1=0.45mol•L-1•min-1;
通过以上分析知,反应速率快慢顺序是D>B>A>C,所以最快的是D,
故选D.
点评 本题考查化学反应速率大小比较,在比较反应速率快慢之前单位要统一,再根据化学反应速率与计量数的比值大小判断,也可以将不同物质转化为同一种物质判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
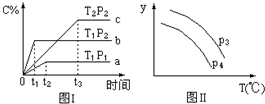
| A. | P3>P4,y轴表示B的转化率 | |
| B. | P3<P4,y轴表示B的体积分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3<P4,y轴表示混合气体的平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与酸反应产生氢气多 | B. | 与碱反应产生氢气多 | ||
| C. | 一样多 | D. | 不知道铝粉的质量,无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
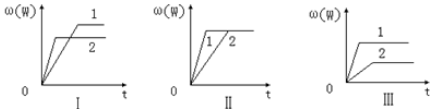
| A. | 图Ⅰ可能是不同压强对反应的影响,且P2>P1,m+n<p | |
| B. | 图Ⅱ可能是不同压强对反应的影响,且P1>P2,m+n=p | |
| C. | 图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0 | |
| D. | 若m+n<p,△H>0,则该反应在低温下容易自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说Ksp(AgCl)<Ksp(AgBr) | |
| C. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com