
【题目】A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大。A与E同主族,D与F同主族,且A与D能形成两种液态化合物;B的某种单质是自然界中硬度最大的物质,C与D形成的化合物是大气常见污染物之一。请回答下列问题:
(1)F在元素周期表中的位置是______________,D、E、F三种元素其简单离子半径由大到小的顺序是_______________________用离子符号表示
(2)元素A、C、F形成的化合物(CA4)2F中含有的化学键为_________________。
(3)元素B、C的最高价氧化物对应水化物酸性较强的是填化学式__________,写出该酸的浓溶液与少量铜粉反应的化学方程式_______________________________。
(4)写出由A、C形成的18电子分子的结构式为________________________。
(5)处理含![]() 废水的方法之一是在微生物的作用下,
废水的方法之一是在微生物的作用下,![]() 被D的常见单质氧化成
被D的常见单质氧化成![]() ,同时生成C的简单氢化物,该反应的离子方程式为_____________________。
,同时生成C的简单氢化物,该反应的离子方程式为_____________________。
【答案】第三周期ⅥA族 S2—>O2—>Na+ 离子键、(极性)共价键 HNO3 Cu +4HNO3(浓)= Cu(NO3)2 +2NO2↑+2H2O ![]() 2CN- + O2 + 4H2O = 2HCO3- +2NH3
2CN- + O2 + 4H2O = 2HCO3- +2NH3
【解析】
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,A与E同主族,D与F同主族,且A与D能形成两种液态化合物,则A为H元素,D为O元素;两种液态化合物,为H2O、H2O2,B的某种单质是自然界中硬度最大的物质,B为C元素,D与F同主族,F为S元素;A与E同主族,E介于D、F之间,E为Na,C与D形成的化合物是大气常见污染物之一,C介于B、D之间,C为N,结合相关性质解答。
根据上述分析可知,A为H元素,B为C元素,C为N元素,D为O元素,E为Na元素,F为S元素,则
(1)F为S,原子序数为16,在元素周期表中的位置是第三周期ⅥA族;电子层数越大,简单离子半径越大;电子层数相同时,核电荷数越小,简单离子半径越大,D、E、F三种元素其简单离子半径由大到小的顺序是S2—>O2—>Na+,故答案为:第三周期ⅥA族;S2—>O2—>Na+;
(2)元素A、C、F形成的化合物为(NH4)2S,是由硫离子与铵根离子构成,铵根离子N与H之间以(极性)共价键结合而成,故该分子中化学键类型为:离子键、(极性)共价键;
(3)元素非金属性越强,最高价氧化物对应的水化物的酸性越强,因非金属性:N>C,故
二者最高价含氧酸的酸性较强的为硝酸,化学式为:HNO3;铜与浓硝酸发生氧化还原反应生成硝酸铜、二氧化氮与水,其化学方程式为:Cu +4HNO3(浓)= Cu(NO3)2 +2NO2↑+2H2O,故答案为:HNO3;Cu +4HNO3(浓)= Cu(NO3)2 +2NO2↑+2H2O;
(4)A、C形成的18电子分子为N2H4,N与H原子均处于稳定结构,其结构式为:![]() ;
;
(5)B为C元素,C为N,BC为CN,D为O元素;BC被D的单质氧化成HCO3,同时生成C的简单氢化物NH3,该反应的离子方程式为:2CN- + O2 + 4H2O = 2HCO3- +2NH3。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】在不同条件下分别测得反应2SO2+O2![]() 2SO3的化学反应速率,其中表示该反应进行最快的是( )
2SO3的化学反应速率,其中表示该反应进行最快的是( )
A. v(SO2)=4 mol·L-1·min-1B. v (O2)=3 mol·L-1·min-1
C. v (SO3)="0.1" mol·L-1·s-1D. v (O2)=0.1mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A. NaHS水解反应:HS-+H2O ![]() H3O++S2-
H3O++S2-
B. Fe(OH)2与稀硝酸反应:2H++Fe(OH)2=Fe2++2H2O
C. 过量的SO2通入到漂白粉溶液中:ClO-+SO2+H2O=HClO+HSO3-
D. Na2CO3水溶液中存在平衡:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 通常状况下,11.2 LH2所含的氢原子数为NA
B. 实验室中用含4mol H2SO4的浓硫酸跟足量铜片加热反应制得的SO2分子数为2NA
C. 0.1 mol·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA
D. 2.4 g Mg与足量稀HCl完全反应,转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1mol·L-1的四种溶液pH如下表,依据已有的知识和信息进行判断,下列说法正确的是
溶质 | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
pH | 11.6 | 10.3 | 9.7 | 4.0 |
A. 常温下,HSO3-的水解能力强于其电离能力
B. 向氯水中加入少量NaHCO3固体,不能增大HClO的浓度
C. Na2CO3 溶液中存在以下关系:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
D. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH依次升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 氯化铁溶液溶解铜片:Fe3++ Cu=Fe2++ Cu2+
B. 氯气与水反应:Cl2 + H2O ![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
C. 硝酸银溶液中加入过量氨水:Ag+ + NH3·H2O=AgOH↓+ NH4+
D. Ca(HCO3)2溶液与少量NaOH溶液反应: Ca2++ HCO3-+ OH-=CaCO3↓+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
I. 已知:①N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1 ②CO的燃烧热△H= - 283 kJ·mol-1
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质,该反应的热化学方程式为_________________________________________________。
(2)一定温度下,在恒容密闭容器中充入1 molNO和2 molCO进行该反应,下列能判断反应达到化学平衡状态的是_______。
①单位时间内消耗a mo1 CO的同时生成2a mol NO
②混合气体的平均相对分子质量不再改变
③混合气体中NO和CO的物质的量之比保持不变
④混合气体的密度不再改变
II. 臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
t/s | 0 | 3 | 6 | 12 | 24 | 36 |
甲容器(T1)n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
乙容器(T2)n(O2)/mol | 0 | 0.30 | 0.50 | 0.70 | 0.85 | 0.85 |
(3)T1___T2(填>、<或=,下同),该反应ΔH___0 。简述理由________________________________。
(4)甲容器中,0~3s内的平均反应速率v(NO2)=______________________。
(5)甲容器中NO2平衡转化率为________,T1时该反应的平衡常数为_______________________。
III. 将NO2(g)转化为N2O4(g),再以
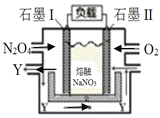
(6)石墨I为______极(选填正、负),Y化学式为_________。
(7)II电极反应式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将pH=8的NaOH溶液稀释1000倍,稀释后溶液中c(Na+)与c(OH-)之比接近
A. 1:1 B. 1:102 C. 102:1 D. 1:103
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物m、n、P存在如下转化关系。下列说法正确的是

A. m、n不存在同分异构体,p存在多种同分异构体
B. m、n、p均能使酸性高锰酸钾溶液褪色
C. m、n、p中所有原子可能共面
D. 等质量的m、n、p,完全燃烧耗氧量不相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com