
在常温下,发生下列几种反应①2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O ②Cl2+2NaBr=2NaCl+Br2 ③Br2+2FeBr2=2FeBr3根据上述反应,下列结论正确的是( )
A. 还原性强弱顺序为:Br﹣>Fe2+>Cl﹣
B. 氧化性强弱顺序为:MnO4﹣>Cl2>Br2>Fe3+
C. 反应①中,当生成1mol Cl2时,被氧化的HCl为3.2mol
D. 溶液中可发生反应:2Fe3++2Cl﹣=2Fe2++Cl2↑
考点: 氧化性、还原性强弱的比较;氧化还原反应的计算.
专题: 氧化还原反应专题.
分析: A、根据还原剂的还原性>还原产物还原性判断.
B、根据氧化剂的氧化性>氧化产物氧化性判断.
C、反应①中只有氯元素被氧化,根据氯原子守恒计算.
D、氯气氧化性比Fe3+强,该离子反应不能发生.
解答: 解:①2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,氧化剂为KMnO4,氧化产物为Cl2,所以氧化性KMnO4>Cl2;还原剂为HCl,还原产物为 MnCl2,所以还原性HCl>MnCl2;
②Cl2+2NaBr=2NaCl+Br2 ,氧化剂为Cl2,氧化产物为Br2,所以氧化性Cl2>Br2;还原剂为NaBr,还原产物为NaCl,所以还原性NaBr>NaCl;
③Br2+2FeBr2=2FeBr3,氧化剂为Br2,氧化产物为,所以氧化性Br2>Fe3+;还原剂为Fe2+,还原产物为Br﹣,所以还原性Fe2+>Br﹣;
A、由上述分析可知,还原性强弱顺序为:Fe2+>Br﹣>Cl﹣,故A错误;
B、由上述分析可知,氧化性强弱顺序为:MnO4﹣>Cl2>Br2>Fe3+,故B正确;
C、反应①中只有氯元素被氧化,氯原子守恒可知,1mol Cl2时,被氧化的HCl为2mol,参加反应的HCl为3.2mol,故C错误;
D、由上述分析可知,氧化性强弱顺序为:MnO4﹣>Cl2>Br2>Fe3+,所以氯气能将亚铁离子氧化为铁离子,Fe3+不能氧化Cl﹣,故D错误.
故选:B.
点评: 考查氧化还原反应概念判断、氧化性还原性强弱判断、守恒计算等,难度中等,关键根据元素化合价变化判断氧化剂与还原剂、还原产物与氧化产物.


科目:高中化学 来源: 题型:
如图是某课外活动小组的同学设计的4个喷泉实验方案.下列有关操作不可能引发喷泉现象的是( )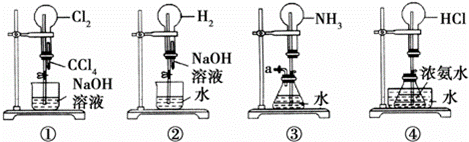
|
| A. | 挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹 |
|
| B. | 挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹 |
|
| C. | 用鼓气装置从装置③的a处不断鼓入空气并打开止水夹 |
|
| D. | 向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在a g环已烷,乙醛,葡萄糖,甲酸甲酯的混合物中,已知氧元素的质量分数为b,则碳元素的质量分数是( )
|
| A. | 1﹣b | B. |
|
|
| C. |
| D. | 数据不全无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
同分异构体具有( )
①相同的相对分子质量 ②相同的分子式 ③相同的结构式 ④相同的物理性质 ⑤相同的化学性质.
A. ①② B. ②③⑤ C. ①②⑤ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A. 阴、阳离子间通过静电引力所形成的化学键是离子键
B. 含有共价键的化合物必是共价化合物
C. 化学变化过程,一定会破坏旧的化学键,同时形成新的化学键
D. 液态氯化氢中存在H+和Cl﹣,所以能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
某K2CO3固体样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种.现将13.8g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9g沉淀.对样品所含杂质判断完全正确的是( )
A. 肯定有KNO3
B. 肯定有KNO3,可能还含有Na2CO3
C. 肯定没有Ba(NO3)2,可能有KNO3
D. 肯定没有Na2CO3和Ba(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质用途的叙述中,不正确的是( )
|
| A. | 硅可用于制作半导体材料 |
|
| B. | 二氧化硅可用于制造光导纤维 |
|
| C. | 石墨可用作绝缘材料 |
|
| D. | 液氨可用作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
酯类物质广泛存在于香蕉、梨等水果中.某实验小组先从梨中分离出一种酯,然后将分离出的酯水解,得到了乙酸和另一种化学式为C6H13OH的物质.对于此过程,以下分析中不正确的是( )
|
| A. | C6H13OH分子含有羟基 |
|
| B. | C6H13OH可与金属钠发生反应 |
|
| C. | 实验小组分离出的酯可表示为CH3COOC6H13 |
|
| D. | 不需要催化剂,这种酯在水中加热即可大量水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某品牌奶粉被鉴定为所含亚硝酸盐残留量高出正常值7.8倍,长期食用可能致癌.NaNO2有像食盐一样的咸味,能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O.
(1)上述反应中若有1.75mol的还原剂被氧化,则被还原的氧化剂是 mol.
(2)某厂废切削液中,含2%~5%的NaNO2,直接排放会造成污染,下列试剂 能使NaNO2转化为不引起二次污染的N2.(填编号)①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
反应的化学方程式为 .若此废水呈强碱性,需调节溶液的pH接近中性,再添加氯化铵溶液,否则会引起二次污染,反应的方程 .
(3)向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸.下列离子方程式与事实不相符的是
A.OH﹣+CO32﹣+2H+→HCO3﹣+H2O B.2OH﹣+CO32﹣+3H+→HCO3﹣+2H2O
C.2OH﹣+CO32﹣+4H+→CO2↑+3H2O D.OH﹣+CO32﹣+3H+→CO2↑+2H2O.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com