
| 编号 | 实验操作 | 目的 |
| A | 取4gNaOH固体溶于100mL水中 | 配制0.1mol•L-1NaOH溶液 |
| B | 向沸水中逐滴加入1-2mLFeCl3饱和溶液,搅拌并继续煮沸到变成红褐色 | 制备Fe(OH)3胶体 |
| C | 测定等物质的量浓度的盐酸、硝酸的pH | 比较Cl、N的非金属性 |
| D | 用MgCl2、AlCl3溶液做导电性试验 | 证明两者是离子化合物还是共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.n(NaOH)=$\frac{4g}{40g/mol}$=0.1mol,c=$\frac{n}{V}$中V指溶液体积而不是溶剂体积;
B.制备氢氧化铁胶体时不能搅拌且不能长时间煮沸;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,不能根据氢化物水溶液酸性强弱判断非金属性强弱;
D.熔融状态下能导电的化合物是离子化合物.
解答 解:A.n(NaOH)=$\frac{4g}{40g/mol}$=0.1mol,c=$\frac{n}{V}$中V指溶液体积而不是溶剂体积,取4gNaOH固体溶入100mL水中,溶液体积大于0.1L,所以配制溶液浓度小于1mol/L,故A错误;
B.制备氢氧化铁胶体时不能搅拌且不能长时间煮沸,否则易产生沉淀,应该将溶液煮沸至红褐色停止加热,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,不能根据氢化物水溶液酸性强弱判断非金属性强弱,所以不能根据盐酸酸性强弱判断Cl元素非金属性强弱,故C错误;
D.离子化合物是由阴阳离子构成的,熔融状态下离子化合物中含有自由移动离子而导电,所以熔融状态下能导电的化合物是离子化合物,熔融状态下不导电的化合物是共价化合物,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及非金属性强弱判断、物质制备、溶液配制、离子化合物和共价化合物判断等知识点,把握物质的性质、反应原理等为解答的关键,侧重分析与实验能力的考查,易错选项是B.


科目:高中化学 来源: 题型:选择题
| A. | 某溶液与Na0H溶液共热.产生使湿润的石蕊试纸变红的气体,说明原溶液中存在NH${\;}_{4}^{+}$ | |
| B. | 某溶液中加人AgN03溶液时,产生白色沉淀.说明原溶液中含有Cl- | |
| C. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧时,火焰呈黄色,说明原溶液中含有金属钠 | |
| D. | 某溶液中加人BaCl2溶液时,产生白色沉淀.原溶液中可能存在Ag+或SO42-或CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 金属 | Na | Cu | Al | Fe |
| 熔点/℃ | 97.5 | 1 083 | 660 | 1 535 |
| 沸点/℃ | 883 | 2 595 | 2 200 | 3 000 |
| A. | Cu与Na | B. | Fe与Cu | C. | Fe与Al | D. | Al与Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与硝酸反应:Fe3O4+8H+ ═Fe2++2Fe3++4H2O | 书写正确 |
| B | 工业制粗硅:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | 错误,生成物应是Si和CO |
| C | NaAlO2溶液与少量CO2反应: AlO2- ̄+CO2+2H2O═HCO3- ̄+Al(OH)3↓ | 书写正确 |
| D | NaHCO3溶液中加入少量石灰水:Ca2++2OH-+2HCO-3=CaCO3↓+CO32-+2H2O | 错误,生成物 中不含CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
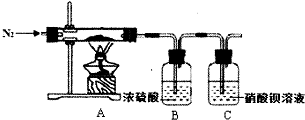 硫酸亚铁铵又称为摩尔盐,是一种重要的化工原料,其组成可表示为x(NH4)2S04•yFeS04•zH20.某兴趣小组探究组成中的x、y、z的数值.
硫酸亚铁铵又称为摩尔盐,是一种重要的化工原料,其组成可表示为x(NH4)2S04•yFeS04•zH20.某兴趣小组探究组成中的x、y、z的数值.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
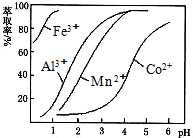
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com