
(11分)研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料:
已知:H2(g)+1/2O2(g)=H2O(g)
 H= −241.8kJ/mol
H= −241.8kJ/mol
C(s)+1/2O2(g)=CO(g)  H= −110.5kJ/mol
H= −110.5kJ/mol
写出焦炭与水蒸气反应制H2和CO的热化学方程式 。
(2)一定条件下,在密闭容器内,SO2被氧化成SO3的热化学方程式为:2SO2(g)+O2(g)  2SO3(g);
2SO3(g);
△H=−a kJ/mo1,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A.4mo1 SO2和2mol O2 B.4mol SO2、2mo1 O2和2mol SO3
C.4mol SO2和4mo1 O2 D.6mo1 SO2和4mo1 O2
(3)汽车尾气中NOx和CO的生成及转化:
①已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g)
2NO(g)
 H>0
H>0
在一定温度下的定容密闭容器中,能说明此反应已达平衡的是
A.压强不变 B.混合气体平均相对分子质量不变
C.2v正(N2)=v逆(NO) D. N2的体积分数不再改变
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)
 H>0,
H>0,
简述该设想能否实现的依据 。
(4)燃料CO、H2在一定条件下可以相互转化:CO(g)+H2O(g)  CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为
。
CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为
。
(1)C(s)+H2O(g)=CO(g)+H2(g)  H=+131.3kJ/mol (3分)(方程式及下标正确可给1分)
H=+131.3kJ/mol (3分)(方程式及下标正确可给1分)
(2)D (2分)
(3)①CD (2分)
②该反应是焓增、熵减的反应。根据 G=
G= H—T
H—T S,
S,
 G>0,不能实现。 (2分)
G>0,不能实现。 (2分)
(4)75% (2分)
【解析】
试题分析:(1)已知:H2(g)+1/2O2(g)=H2O(g)
 H1= −241.8kJ/mol ;C(s)+1/2O2(g)=CO(g)
H1= −241.8kJ/mol ;C(s)+1/2O2(g)=CO(g)
 H2= −110.5kJ/mol根据盖斯定律,用方程式2减去方程式1,可得:写出焦炭与水蒸气反应制H2和CO的热化学方程式(1)C(s)+H2O(g)=CO(g)+H2(g)
H2= −110.5kJ/mol根据盖斯定律,用方程式2减去方程式1,可得:写出焦炭与水蒸气反应制H2和CO的热化学方程式(1)C(s)+H2O(g)=CO(g)+H2(g)  H=+131.3kJ/mol 。(2)由反应方程式可知生成2mol的SO3时放热a kJ,想得到2a kJ热量,则需生成4molSO3;由于反应是可逆反应,不可能完全进行到底,所以要得到4molSO3,SO2与O2物质的量必须要多于4mol和 2mol,故D符合,B选项中既有正反应又有逆反应,最终放出的热量小于2akJ,故选D.(3)①A.由于反应前后体积不变,故压强始终不变不能做为平衡判断依据,错误; B.由于反应前后总质量和总物质的量都不改变,故混合气体平均相对分子质量不变,故不能做为平衡判断依据,错误;选CD。②由反应2CO(g)=2C(s)+O2(g)
H=+131.3kJ/mol 。(2)由反应方程式可知生成2mol的SO3时放热a kJ,想得到2a kJ热量,则需生成4molSO3;由于反应是可逆反应,不可能完全进行到底,所以要得到4molSO3,SO2与O2物质的量必须要多于4mol和 2mol,故D符合,B选项中既有正反应又有逆反应,最终放出的热量小于2akJ,故选D.(3)①A.由于反应前后体积不变,故压强始终不变不能做为平衡判断依据,错误; B.由于反应前后总质量和总物质的量都不改变,故混合气体平均相对分子质量不变,故不能做为平衡判断依据,错误;选CD。②由反应2CO(g)=2C(s)+O2(g)
 H>0,可知该反应是焓增、熵减的反应。根据
H>0,可知该反应是焓增、熵减的反应。根据 G=
G= H—T
H—T S,
S,
 G>0,不能实现。
G>0,不能实现。
(4)解:令平衡时CO的浓度变化量为xmol/L,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g)
开始(mol/L):0.1 0.1 0 0
变化(mol/L):c c c c
平衡(mol/L):0.1-c 0. 1-c c c
故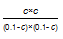 =9
解得c=0.075,故一氧化碳在此条件下的平衡转化率=75%,故答案为:75%.
=9
解得c=0.075,故一氧化碳在此条件下的平衡转化率=75%,故答案为:75%.
考点:本题考查了化学平衡的有关计算、化学平衡常数的应用,判断反应进行的程度、判断反应进行的方向等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 (2009?泰州模拟)二氧化硫是常用的化工原料,但也是大气的主要污染物.
(2009?泰州模拟)二氧化硫是常用的化工原料,但也是大气的主要污染物.| 催化剂 | △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、船身镶上锌块能减轻海水对船身的腐蚀,这是利用了原电池原理 | B、废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源 | C、汽油、柴油和植物油都是碳氢化合物 | D、造成大气污染的SO2、CO和NO等,主要来源于煤、石油等化石燃料的燃烧和汽车尾气的排放 |
查看答案和解析>>
科目:高中化学 来源:2012年鲁科版高中化学选修1 3.2家用燃料的更新练习卷(解析版) 题型:选择题
据报道,近年来科学家在百慕大等深海底发现一种新能源,这种物质的外观很象冰。科学研究表明,可燃冰实际上是一种甲烷水合物(CH4·xH2O),是甲烷与水在低温高压下形成的一种固态物质。
(1)目前,排放到大气中的气体污染物主要有SO2、NO2、CO等,它们主要来自矿物燃料的燃烧和工业废气。今有:①可燃冰②氢能③风能④太阳能⑤煤⑥天然气⑦石油等能源,在通常情况下使用上述能源,一般不会造成空气污染的一组是 ( )
A、①②③④⑥ B、②③④⑥⑦ C、①③④⑤⑥ D、①②③④⑤
(2)下面有关甲烷和可燃冰的说法中,不正确的是 ( )
A、甲烷主要是植物残体在隔绝空气的情况下分解而生成的
B、可燃冰燃烧时火焰呈蓝色
C、与煤比较,可燃冰是一种高效能源
D、通常情况下,甲烷是一种无色、无味,易与水化合的气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com