
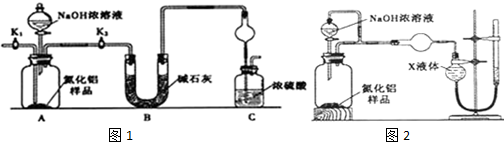
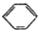
分析 (1)由装置和仪器作用可知,氨气是与浓硫酸能发生反应的气体,易发生倒吸;
(2)组装好实验装置,原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算;
(3)装置存在缺陷是空气中的水蒸气和二氧化碳也可以进入装置C,使测定结果偏高,需要干燥气体;
(4)由氨气极易溶于水的性质可知,为测定生成气体的体积,量气装置中的X液体与氨气不反应,不能溶解氨气;
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),
AlN+NaOH+H2O═NaAlO2+NH3↑
41 22.4L
m V×10-3L
m=$\frac{41V×1{{0}^{-3}}_{\;}}{22.4}$g,以此计算质量分数;
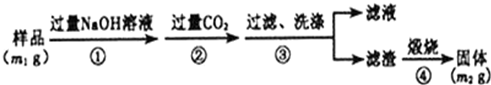
(6)②中偏铝酸根离子与二氧化碳反应生成氢氧化铝;
(7)沉淀不洗涤得到滤渣质量会增大.
解答 解:(1)由装置和仪器作用可知,氨气是与浓硫酸能发生反应的气体,易发生倒吸,图C装置中球形干燥管的作用是防止倒吸的作用,
故答案为:防止倒吸;
(2)组装好实验装置,原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算,
故答案为:检查装置气密性;把装置中残留的氨气全部赶入C装置;
(3)装置存在缺陷是空气中的水蒸气和二氧化碳也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管,
故答案为:C装置出口处连接一个干燥装置;
(4)A.CCl4不能溶解氨气,可以用排四氯化碳溶液的方法测定氨气体积,故A正确;
B.氨气极易溶于水,不能排水法测定,故B错误;
C.氨气极易溶于水,不能用排NH4Cl溶液的方法测定气体体积,故C错误;
D.氨气不溶于苯,可以利用排苯溶液,测定氨气的体积,故D正确;
故答案为:AD;
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),
AlN+NaOH+H2O═NaAlO2+NH3↑
41 22.4L
m V×10-3L
m=$\frac{41V×1{{0}^{-3}}_{\;}}{22.4}$g,则AlN的质量分数为$\frac{4V×1{0}^{-3}}{22.4m}$×100%=$\frac{41V}{22400}$×100%,
故答案为:$\frac{41V}{22400}$×100%;
(6)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成,反应的离子方程式为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,
故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(7)若在步骤③中未洗涤,沉淀不洗涤得到滤渣质量会增大,测定结果会偏高,故答案为:偏高.
点评 本题考查物质性质实验、制备实验及含量测定等,综合性较强,为高频考点,把握制备原理、发生的反应及实验技能为解答的关键,侧重分析与实验能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯与溴能发生取代反应,因此不能用苯萃取溴水中的溴 | |
| B. | 相同质量的苯和立方烷(C${\;}_{{8}_{\;}}$H8)完全燃烧,耗氧量一样多 | |
| C. | 乙烯和聚乙烯都能发生加成反应 | |
| D. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻储存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬脂酸甘油酯属于高级脂肪酸甘油酯,是高分子化合物 | |
| B. | 含淀粉或纤维素的物质可以制造酒精 | |
| C. | 鸡蛋清的溶液中加入硫酸铜溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃C5H12的同分异构体中,主链最短的一种系统命名为2,2-甲基丙烷 | |
| B. | 石油分馏和裂化的目的都是为了将长链烃转化为短链烃 | |
| C. | 蛋白质溶液中加入硫酸铜溶液,导致蛋白质变性,失去生理活性 | |
| D. | 高分子化合物(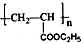 )的单体是CH2=CH2和C2H5COOH )的单体是CH2=CH2和C2H5COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 | |
| D. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol FeCl3 水解生成的Fe(OH)3胶粒数为lNA | |
| B. | 4.6g有机物C2H6O的分子结构中含有的C一H键数目一定为0.5NA | |
| C. | 标准状况下,11.2 L CO2 与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 1 mol/L AlCl3溶液中含有3NA个Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ | ||||||
| B. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,离子方程式为:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | ||||||
| C. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | ||||||
| D. | 碳酸和次氯酸的电离平衡常数见表,二氧化碳通入次氯酸钠溶液中:2NaClO+CO2+H2O═Na2CO3+2HClO
|
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 实验目的或结论 |
| A | 取一个小木条,放入饱和硅酸钠溶液中,充分吸湿、浸透,取出稍沥干后,置于酒精灯外焰处,木条未燃烧 | 证明硅酸钠可作木材防火剂 |
| B | 向取好未知浓度氢氧化钠溶液的锥形瓶中加入2mL酚酞,然后进行正确滴定,最后一滴盐酸滴入,溶液由红色变为无色且半分钟不恢复 | 准确判断已知浓度的盐酸滴定未知浓度的氢氧化钠溶液的滴定的终点 |
| C | 向装有石灰石的简易启普发生器中加入浓醋酸,将产生的气体先通入饱和碳酸氢钠溶液,再通入苯酚钠溶液中,苯酚钠溶液产生浑浊 | 酸性:醋酸>碳酸>苯酚 |
| D | 向盛有苯酚的浓溶液的试管里逐滴加入稀溴水,边滴边振荡 | 苯酚的定性检验 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molNaN3所含阴离子总数为3NA | |
| B. | 常温常压下,28 g乙烯气体中σ键与π键数目之和为6NA | |
| C. | 标准状况下,22.4L C12通入到足量FeBr2溶液中,被氧化的Br-数目为2NA | |
| D. | 500 mL 18 mol/L的H2SO4溶液与足量Cu共热,电子转移数目为9NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com