
| A. | 滴定时,左手控制滴定管活塞,右手握锥形瓶,边滴边振荡,眼睛注视滴定管中液面 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度 |
分析 A.眼睛注视锥形瓶内溶液颜色的变化;
B.蒸馏时,温度计用于测量馏分的温度;
C.分液时,应避免液体重新混合而污染;
D.配制氯化铁溶液时应防止氯化铁水解.
解答 解:A.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视锥形瓶内溶液颜色的变化,故A错误;
B.蒸馏操作时,温度计用于测量馏分的温度,水银球应靠近蒸馏烧瓶的支管口处,故B正确;
C.为防止液体污染,分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒,故C正确;
D.氯化铁是强酸弱碱盐所以在水溶液中能水解,为抑制氯化铁水解,应向氯化铁溶液中加盐酸,所以配制氯化铁溶液时,将一定量氯化铁固体溶解在较浓的盐酸中,再用水稀释到所需浓度,故D正确.
故选A.
点评 本题考查较为综合,涉及物质中和滴定、物质的分离以及溶液的配制,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握操作的方法,难度不大,注意相关基础知识的积累.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚沾在手上立即用酒精清洗 | B. | 误食铜盐立即喝牛奶或蛋清 | ||
| C. | 动物标本可用福尔马林浸泡防腐 | D. | 伤口处理应先用100%的乙醇消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
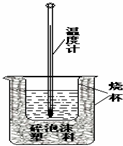 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶 液进行中和热的测定,实验装置如图所示.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶 液进行中和热的测定,实验装置如图所示. | 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 |
| 2 | 25.9 | 25.9 | 25.9 | 29.8 |
| 3 | 26.4 | 26.2 | 26.3 | 30.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾的相对原子质量较大 | |
| B. | 钾的密度比钠小 | |
| C. | 钾的原子半径大,失去电子的能力强 | |
| D. | 钾比钠与水反应更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com