
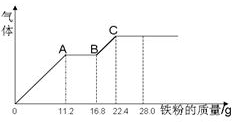
| A��ԭ���Һ��NO3-�����ʵ���Ϊ0��4mol |
| B��c(H2SO4)Ϊ5mol��L-1 |
| C����Һ����������ΪFeSO4 |
| D��OA�β�����NO��AB�η�ӦΪ2Fe3++Fe = 3Fe2+��BC�β������� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢ڡ��� | B���ڢܢݡ��� | C���ڢۢܢݡ� | D���٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��50��8 g | B��66��4 g | C��44��8g | D��39��2g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������Ũ����������� |
| B������ʹʪ�����ɫʯ����ֽ��� |
| C������ͨ�˷�̪��Һ�У���Һ��� |
| D������ʹʪ��ĺ�ɫʯ����ֽ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��H2O2��Na2O2�����ڹ�����������ڹ��ۼ� |
| B��˫��ˮ����ɫ������������ҽ�������� |
| C��H2O2�ڹ�������ø�Ĵ��£��¶�Խ�ߣ��ֽ�����Խ�� |
| D��H2O2��Ư���������������ԣ�Ư��ԭ����HClO���ơ���SO2��ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
| | NaCl | NaHCO3 | NH4Cl |
| 10�� | 35.8 | 8.15 | 33.0 |
| 45�� | 37.0 | 14.0 | 50.0 |
 ��4��������b�Ma��ȡֵ��Χ����֮��Ӧ����Һ�����ʼ������ʵ���������������±��У�
��4��������b�Ma��ȡֵ��Χ����֮��Ӧ����Һ�����ʼ������ʵ���������������±��У�| b�Ma��ȡֵ��Χ | ���� | �������ʵ��� |
| | | |
 | ���� | ���� |
| | | |
| | | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��(NH4)2SO4 | B��NH4Cl | C��NH4NO3�� | D��NH4HCO3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com