
【题目】如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
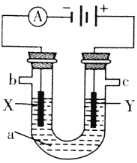
(1)若X、Y是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞,则:
①电解池中在X极附近观察到的现象是________。
②检验Y电极上电极反应产物的方法是________。
(2)若用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①Y电极的材料是_______,电极反应式是_____。(说明:杂质发生的电极反应不必写出)
②当电路中有0.04mol电子通过时,阴极增重________g。
【答案】有气泡产生,溶液变红色将湿润的KI-淀粉试纸置于c口处,试纸变蓝粗铜Cu-2e-=Cu2+1.28
【解析】
(1)电解饱和食盐水时,阳极上是氯离子失电子,阴极上是氢离子得电子,氯气能使湿润的碘化钾淀粉试纸变蓝;
(2)电解方法精炼粗铜,电解液a选用CuSO4溶液,粗铜做阳极,精铜做阴极;依据电子守恒计算析出铜的质量。
(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,即电解池中在X极附近观察到的现象是有气泡产生,溶液变红色;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl――2e-=Cl2↑,氯气能使湿润的碘化钾淀粉试纸变蓝,可以用于氯气的检验,即将湿润的KI-淀粉试纸置于c口处,试纸变蓝,说明生成的气体是氯气;
(2)①电解方法精炼粗铜,电解池的阴极材料是纯铜,阳极是粗铜,则Y电极的材料是粗铜,电极反应为Cu-2e-=Cu2+;
②假若电路中有0.04mol电子通过时,阴极电极反应Cu2++2e-=Cu,则阴极增重铜0.02mol,质量为0.02mol×64g/mol=1.28g。


科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:

回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯(C4H8)是制备线性低密度聚乙烯(LLDPE)的原料之一,可由丁烷(C4H10)催化脱氢制备,C4H10(g)![]() C4H8(g)+H2(g)
C4H8(g)+H2(g) ![]() H=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[
H=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[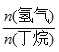 ]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
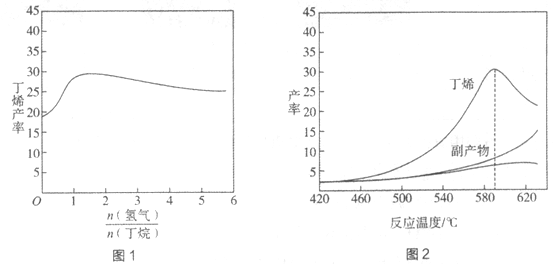
下列分析正确的是
A. 氢气的作用是活化固体催化剂,改变氢气量不会影响丁烯的产率
B. 丁烷催化脱氢是吸热反应,丁烯的产率随温度升高而不断增大
C. 随温度升高丁烯裂解生成的副产物增多,会影响丁烯的产率
D. 一定温度下,控制进料比[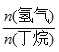 ]越小,越有利于提高丁烯的产率
]越小,越有利于提高丁烯的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积为1L干燥容器中充入HCl气体后,测得容器中气体对氧气的相对密度为1.082。将此气体倒扣在水中,进入容器中液体的体积是
A. 0.25L B. 0.5L C. 0.75L D. 1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度为________。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
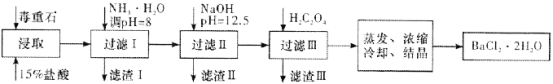
①毒重石用盐酸浸取前需充分研磨,目的是________。
②加入NH3·H2O调节pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL 0.01mol·L-1 Na2SO4溶液,下列叙述正确的是___(填字母)。
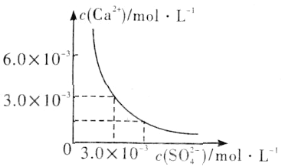
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子核外电子是分层排布的,下列关于L层与M层的说法不正确的是( )
A.L层离核比M层离核近
B.电子在M层上运动时所具有的能量高于L层
C.当L层上的电子数为奇数时,M层上不可能有电子
D.当L层上的电子数为偶数时,M层上一定有电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员研制出一种新型储备电源—锂水电池(结构如图,高硅铸铁为惰性辅助电极),使用时加入水即可放电。下列关于该电池工作时的说法正确的是
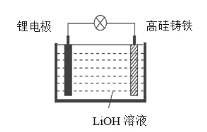
A. 高硅铸铁发生氧化反应B. OH-向高硅铸铁电极移动
C. 负极的电极反应式为Li-e-![]() Li+D. 电流的方向:锂电极→导线→钢电极
Li+D. 电流的方向:锂电极→导线→钢电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 2.0mol/L的盐酸中Cl—的物质的量为( )
A. 2.0mol B. 0.20mol C. 1.0mol D. 0.10mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是( )
A.蒸馏操作时,冷凝水的方向应由下往上
B.分液时,首先要使玻璃塞上的凹槽与上口部小孔对准,再进行分液
C.提取碘水中的碘单质时,应选择有机萃取剂,如酒精
D.萃取分液后,要得到被萃取的物质,通常还要进行蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com