
| �¶ȣ��棩 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| ƽ��������Ũ�� ��10-3mol/L�� | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
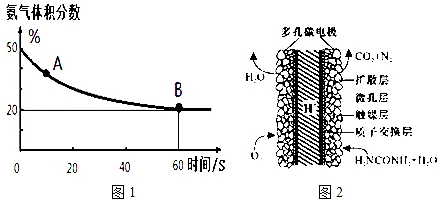
���� ��1�����������������50%�仯Ϊ20%������������ֲ��䣬˵��B�㷴Ӧ�ﵽƽ��״̬��A�㰱������ٷֺ�������B�İ�������ٷֺ�����˵����Ӧ������дﵽƽ��״̬��
�谱���������ʵ���x����ʼ�����������Ϊ50%�����谱��Ϊ50mol��������̼Ϊ50mol��
CO2+2NH3?��NH2��2CO+H2O
��ʼ����mol�� 50 50 0 0
�仯����mol�� 0.5x x 0.5x 0.5x
ƽ������mol��50-0.5x 50-x 0.5x 0.5x
�������������=$\frac{50-x}{50-0.5x+50-x+0.5x}$=20%��
�Դ˼���ת���ʣ�
��2���ٸ��ݱ��е����ݷ������¶�Խ�ߣ���ƽ���������Ũ��Խ�����������¶ȣ�ƽ�������ƶ�������Ӧ��Ӧ�Ƿ��ȷ�Ӧ����Ӧ�������壬�����ǹ��壬�÷�Ӧ���ؼ�С�Ĺ��̣�
��A����Ϊ���������Ϊ���壬����������İ�������泥�ƽ�ⲻ�ƶ���
B��ƽ��ʱ������ϵ�¶ȣ�ƽ������ȷ�������Ӧ�����ƶ����ְ��������Ϊ���壬����NH3��CO2ʼ��Ϊ2��1��
C����Ϊ�����Ϊ2��1��NH3��CO2���������뷴Ӧ��NH3��CO2�ְ���2��1�����ģ�����NH3��ת����ʼ�յ���CO2��ת���ʣ�
D������ֻ�ı����ʣ����ı�ƽ���ƶ���
����Ϊ��������識���ˮ���̼��泥�����ӦʽΪNH2COONH4��s��+H2O?��NH4��2CO3������1L0.1mol/L��������Һ��ֱ����ҺpH=7������Һ�м�������̼Ԫ�أ�������Һ��ֻ��H+��NH4+��OH-��Cl-�����ݵ���غ�c��NH4+��=c��Cl-��=0.1mol/L������ȥ0.052mol��������泥����Կ�ʼ��Һ�е�笠�����Ũ��Ϊ0.052mol/L��2=0.104mol/L��
NH4++H2O?NH3•H2O+H+��
��ʼ 0.104mol/L 0
ת�� 0.004mol/L 0.004mol/L
ƽ�� 0.1mol/L 0.004mol/L
����ҺΪpH=7������������Ũ��Ϊ10-7mol/L���Դ˼���NH4+ˮ��ƽ�ⳣ��K��
��3������ȼ�ϵ���������ڸ�����ʧȥ�������ɵ�����������̼��
��� �⣺��1�����������������50%�仯Ϊ20%������������ֲ��䣬˵��B�㷴Ӧ�ﵽƽ��״̬��A�㰱������ٷֺ�������B�İ�������ٷֺ�����˵����Ӧ������дﵽƽ��״̬��A�������Ӧ���ʴ���B�������Ӧ���ʣ���v����CO2����v����CO2����
�谱���������ʵ���x����ʼ�����������Ϊ50%�����谱��Ϊ50mol��������̼Ϊ50mol��
CO2+2NH3?��NH2��2CO+H2O
��ʼ����mol�� 50 50 0 0
�仯����mol�� 0.5x x 0.5x 0.5x
ƽ������mol��50-0.5x 50-x 0.5x 0.5x
�������������=$\frac{50-x}{50-0.5x+50-x+0.5x}$=20%��
���x=37.5mol��
������ƽ��ת����=$\frac{37.5mol}{50mol}$��100%=75%��
�ʴ�Ϊ������75%��
��2���ٸ��ݱ��е����ݷ������¶�Խ�ߣ���ƽ���������Ũ��Խ�����������¶ȣ�ƽ�������ƶ�������Ӧ��Ӧ�Ƿ��ȷ�Ӧ���ʡ�H��0��
��Ӧ�������壬�����ǹ��壬�÷�Ӧ���ؼ�С�Ĺ��̣�������S��0��
�ʴ�Ϊ��A��
��A����Ϊ���������Ϊ���壬����������İ�������泥�ƽ�ⲻ�ƶ������Է�Ӧ���ת���ʲ��䣬��A����
B��ƽ��ʱ������ϵ�¶ȣ�ƽ������ȷ�������Ӧ�����ƶ����ְ��������Ϊ���壬����NH3��CO2ʼ��Ϊ2��1����CO2������������䣬��B����
C����Ϊ�����Ϊ2��1��NH3��CO2���������뷴Ӧ��NH3��CO2�ְ���2��1�����ģ�����NH3��ת����ʼ�յ���CO2��ת���ʣ���C��ȷ��
D������ֻ�ı����ʣ����ı�ƽ���ƶ������Լ�����Ч�Ĵ������ܹ���߰�������淋IJ��ʣ���D����
�ʴ�Ϊ��C��
����Ϊ��������識���ˮ���̼��泥�����ӦʽΪNH2COONH4��s��+H2O?��NH4��2CO3������1L0.1mol/L��������Һ��ֱ����ҺpH=7������Һ�м�������̼Ԫ�أ�������Һ��ֻ��H+��NH4+��OH-��Cl-�����ݵ���غ�c��NH4+��=c��Cl-��=0.1mol/L������ȥ0.052mol��������泥����Կ�ʼ��Һ�е�笠�����Ũ��Ϊ0.052mol/L��2=0.104mol/L��
NH4++H2O?NH3•H2O+H+��
��ʼ 0.104mol/L 0
ת�� 0.004mol/L 0.004mol/L
ƽ�� 0.1mol/L 0.004mol/L
����ҺΪpH=7������������Ũ��Ϊ10-7mol/L����NH4+ˮ��ƽ�ⳣ��K=$\frac{c��N{H}_{3}��{H}_{2}O��c��{H}^{+}��}{c��N{{H}_{4}}^{+}��}$=$\frac{0.004��1{0}^{-7}}{0.1}$=4��10-9��
�ʴ�Ϊ��0.1mol/L��4��10-9��
��3������ȼ�ϵ���������ڸ�����ʧȥ�������ɵ�����������̼������ӦΪ��CO��NH2��2+H2O-6e-�TN2��+CO2��+6H+��
�ʴ�Ϊ��CO��NH2��2+H2O-6e-�TN2��+CO2��+6H+��
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬���ջ�ѧƽ�����η���ת���ʼ����Ϊ���Ĺؼ������ط�������������Ŀ��飬ע��ˮ��ƽ�ⳣ���ļ��㼰�缫��Ӧ����дΪ�����ѵ㣬��Ŀ�ѶȲ���


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��2mL10%������������Һ�е���2%������ͭ��Һ4��6�Σ���������������ͭ����Һ������ȩ�� | |
| B�� | ʵ���������Ҵ���Ũ��������ϩʱ��Ѹ�����µ�140�� | |
| C�� | ʢ�Ź����ӵ��Լ�ƿ�в����ı��ӣ���ˮϴ�� | |
| D�� | ȡ����������ɫ����ά��ˮ��Һ�������������Ƶ�������ͭ����Һ���ȣ�֤��ˮ�����Ϊ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
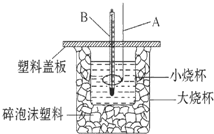 ��֪H+��aq��+OH-��aq���TH2O��l����H=-57.3kJ•mol-1���ش��й��кͷ�Ӧ�����⣮
��֪H+��aq��+OH-��aq���TH2O��l����H=-57.3kJ•mol-1���ش��й��кͷ�Ӧ�����⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʽ�ζ���������ˮϴ����ֱ��ע���Ũ�ȵ�NaOH��Һ | |
| B�� | ��ʽ�ζ��ܼ�������ݣ��ζ���������ʧ | |
| C�� | ��¼���ĵļ�Һ���ζ�ǰƽ�ӣ��ζ����Ӱ�Һ�� | |
| D�� | ��ƿ������ˮϴ����ֱ��װ��δ֪Ũ�ȵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na+ | B�� | Cl- | C�� | ca2+ | D�� | S2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
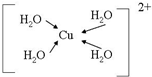 ����λ���á��������
����λ���á���������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  | B�� | 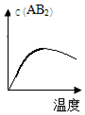 | C�� |  | D�� | 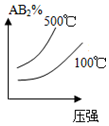 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ĸɱ� | B�� | ����ĺ�ˮ | C�� | ���µĿ��� | D�� | ��Ӳ�Ĵ���ʯ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
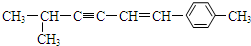 ������˵������ȷ���ǣ�������
������˵������ȷ���ǣ�������| A�� | �÷��������е�̼ԭ�Ӿ����ܴ���ͬһƽ���� | |
| B�� | �÷�����һ�������̼ԭ��������Ϊ8�� | |
| C�� | �÷�����������9��̼ԭ�Ӵ���ͬһ��ֱ���� | |
| D�� | �÷����п��ܹ����̼ԭ�������Ϊ13�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com