
| A. | C12H22O11 | B. | SO3 | C. | NaHCO3 | D. | Br2 |
分析 电解质是指在水溶液或熔化状态下能导电的化合物,而非电解质是指在水溶液和熔化状态下都不能导电的化合物.
解答 解:A、C12H22O11其水溶液不导电,是非电解质,故A错误;
B、SO3的水溶液能导电,是因SO3和水反应生成硫酸,硫酸电离生成离子而导电,即发生电离不是SO3本身,故SO3属于非电解质,故B正确;
C、NaHCO3的水溶液导电,属于电解质,故C错误;
D、Br2其水溶液导电,但不是物质本身导电,Br2的成分是单质,不是非电解质,故D错误.
故选B.
点评 本题考查电解质和非电解质,学生应明确电解质和非电解质都是化合物,并明确判断电解质时发生电离的为化合物本身来分析解答即可.


科目:高中化学 来源: 题型:实验题

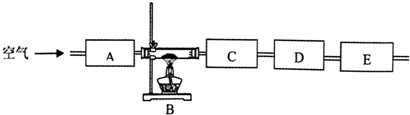
| 仪器 编号 | 药品 | 目的 |
| A | 碱石灰 | |
| B | 绿色固体 | |
| C | ||
| D | ||
| E | 碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KI+Br2═2KBr+I2 | B. | CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ | ||
| C. | SO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$H2SO4 | D. | MgCl2+2NaOH $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
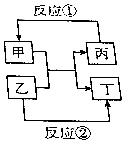 物质甲、乙、丙、丁的相互转化关系如图所反应所示(部分反应物、产物及反应条件已略去),已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物.回答下列间题:
物质甲、乙、丙、丁的相互转化关系如图所反应所示(部分反应物、产物及反应条件已略去),已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物.回答下列间题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ⑤②③①⑥④⑦ | B. | ⑤①②③⑥④⑦ | C. | ⑤②①③④⑥⑦ | D. | ⑤③②①⑥④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CCl4振荡后,观察下层液体颜色 | |
| C. | 加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察是否出现红色 | |
| D. | 加入CCl4振荡后,取上层清液,滴加入AgNO3溶液,观察是否有AgCl沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20gD2O中含有的中子数为10NA | |
| B. | 0.1molCl2与足量的NaOH溶液反应,转移的电子数为0.2NA | |
| C. | 常温下,pH=13 的NaOH溶液中含有的OH-数为0.1NA | |
| D. | 标准状况下,11.2LCCl4中含有C-Cl键的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
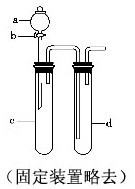 铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.
铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓硝酸 |
| 乙 | Cu、稀硝酸 |
| 丙 | Cu、O2、稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
| ②取少量该溶液,加铜片和浓硫酸,加热 | 有无色气体产生,遇空气变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有不溶于稀硝酸的白色沉淀生成 |
| ⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com