
分析 由反应中的I元素守恒可知:ClO2-~2I2~4S2O32-,令待测溶液的体积为xmL,取了$\frac{1}{10}$,则$\frac{1}{10}$XmL待测溶液中n(NaClO2)=$\frac{1}{4}$×cV×10-3mol,m(NaClO2)=$\frac{1}{4}$×90.5cV×10-3g;样品mg配成xmL待测溶液中的NaClO2质量扩大10倍,计算得到NaClO2的质量分数.
解答 解:由反应中的I元素守恒可知:ClO2-~2I2~4 S2O32-,令待测溶液的体积为xmL,取了$\frac{1}{10}$,则$\frac{1}{10}$xmL待测溶液中n(NaClO2)=$\frac{1}{4}$×cV×10-3mol,m(NaClO2)=$\frac{1}{4}$×90.5cV×10-3g;样品mg配成xmL待测溶液中的NaClO2质量扩大10倍,故样品中NaClO2的质量分数为×100%=$\frac{\frac{1}{4}×90.5×cV×1{0}^{-3}g}{mg}$=$\frac{90.5cV}{4m}$%;
故答案为:$\frac{90.5cV}{4m}$%.
点评 本题考查了有关方程式的计算,题目难度中等,侧重于考查学生分析问题、解决问题的能力和计算能力,注意氧化还原反应滴定中利用关系式进行的计算.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
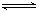 CO(g)+3H2(g)△H=-(a+b-3C)kJ.mol-1.
CO(g)+3H2(g)△H=-(a+b-3C)kJ.mol-1.
查看答案和解析>>
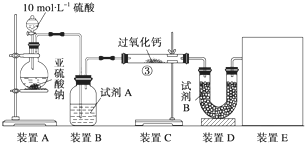
科目:高中化学 来源: 题型:实验题
 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们可以用如图所示的装置制取乙酸乙酯:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们可以用如图所示的装置制取乙酸乙酯:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| C. | 同主族元素随原子核电荷数的递增,原子半径依次增大 | |
| D. | 第ⅦA族元素的单质,随分子量的增大,熔、沸点升高;ⅠA族单质,随分子量的增大,熔、沸点升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10:7:11 | B. | 11:11:8 | C. | 11:10:8 | D. | 10:11:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
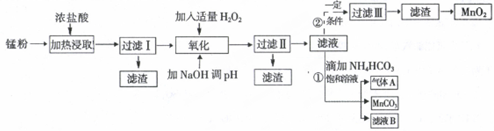
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时pH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时pH | 9.5 | 3.7 | 10.8 | 8.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部可以 | B. | 仅②可以 | C. | 仅②③可以 | D. | ①③④可以 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com