
【题目】常温下,不可能与NaHCO3溶液反应生成气体的物质是( )
A.酸 B.碱 C.盐 D.氧化物
科目:高中化学 来源: 题型:
【题目】氨在国民经济中占有重要地位。
(1)NH3的电子式为
(2)实验室中制取氨气的化学方程式为 ,生成的气体可以用蘸有浓盐酸的玻璃棒来检验,将产物溶于水,溶液呈酸性,用离子方程式表示原因 ;
溶液中离子浓度由大到小的顺序为
(3)欲快速制取氨气,可将浓氨水滴入固体氢氧化钠中,其装置如图,请结合化学用语从化学平衡的角度解释:

(4)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式 ;若将SO2气体通入酸化的硝酸钡溶液,也产生白色沉淀,用离子方程式加以说明 。
(5)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
肼——空气燃料电池是一种碱性电池,该电池放电时,负极的反应式 。
(6)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物。首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.写出氧化吸收法除去氮氧化物的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)毗氟氯禾灵的合成路线如下:

已知:![]()
(1)B的结构简式为_____________。A的系统名称为_____________。
(2)在合成吡氟氯禾灵所涉及的反应中,属于加成反应的有___________(填序号)。
(3)写出反应⑥的化学方程式___________________。
(4)C的同分异构体有多种,写出同时具有下列性质的同分异构体的结构简式___________________。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应 c.核磁共振氢谱图中有四组峰
(5)写出由![]() 制备高分子化合物
制备高分子化合物![]() 的合成路线流程图(无机试剂任选),合成流程示意图如下:
的合成路线流程图(无机试剂任选),合成流程示意图如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中X是无支链的、具有果香味的合成香料,可用于调配多种果香型香精。已知D是一种常见的烃,在标准状况下的密度为1.25 g·L-1,其产量可以用来衡量一个国家石油化工发展水平。E是生活中常见的一种有机物。各物质间转化关系如下:

请回答下列问题:
(1)A的名称是 。
(2)B中所含的官能团是 。
(3)C+E→X的化学反应类型是 反应。
(4)写出任意两种与A具有相同官能团的A的同分异构体的结构简式(不含A): 。
(5)X与氢氧化钠溶液反应的化学方程式是: 。
(6)以D为原料生产一种常见塑料的化学方程式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X2-与Y+离子都与Ar原子具有相同的核外电子排布,则下列叙述中正确的是
A. 原子序数X>Y
B. 离子半径X>Y
C. X和Y一定在同一周期
D. X是第IIA族元素,Y是第VIIA族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】置换反应的通式可表示为:

单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)若单质乙为植物光合作用的产物,则该反应的化学方程式为 。
(2)若单质甲和化合物B均具有磁性,则该反应的化学方程式为 。
(3)若化合物A是红棕色粉末状固体,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则该反应的化学方程式为 。
(4)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式 。
(5)若单质乙是黑色非金属固体单质,化合物B是一种金属氧化物,常用作耐高温材料,则该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃ ),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息:① 四氯化硅遇水极易水解;② SIC14沸点为57.7℃ ,熔点为-70.0℃ 。请回答:
(1)写出装置A 中发生反应的离子方程式_______________。
(2)装置C 中的试剂是___________;装置F的作用是_______________;
装置E 中的h 瓶需要冷却的理由是_______________。
(3)装置E 中h 瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
① 反应的离子方程式:_______________。② 滴定前是否要滴加指示剂?_______________。(填“是”或“否”) ,请说明理由_______________。
③ 滴定前检验Fe3+ 是否完全还原的实验操作是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝。(9分)
(1)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。(2分)
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。(2分)
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是_____________________________________(用离子方程式说明)。(5分)
II、焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。(6分)
(1)根据题意,可判断出X是________(1分)(写化学式)。
(2)写出并配平该反应的化学方程式:_________________________;
(3)发生还原反应的物质是________,反应中2mol的氧化剂能_______(1分)(填“失去”或“得到”)_____mol电子。
(4)反应中被氧化产生了5.6L(标准状况)的气体时,被还原的物质的质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH![]() (CH3CH2CH2CH2)2O+H2O,反应物和产物的相关数据如下表:
(CH3CH2CH2CH2)2O+H2O,反应物和产物的相关数据如下表:
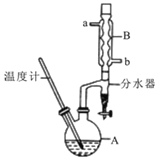

①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
③分离提纯:待A中液体冷却后将其缓慢倒入盛有70 mL水的温度分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g。请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为:应先加 。
(2)加热A前,需先从 (填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去 ,振摇后静置,粗产物应 (填“上”或“下”)口倒出。
(4)步骤⑤中,加热蒸馏时应收集 (填选项字母)左右的馏分。
A.100℃ B.117℃ C.135℃ D.142℃
(5)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为 ,下层液体的主要成分为 。
(6)本实验中,正丁醚的产率为 (精确到1%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com