
【题目】常温下,用NaOH溶液滴定H2C2O4溶液,溶液中-lg[c(H+)/c(H2C2O4)]和-lgc(HC2O4-)或-lg[c(H+)/c(HC2O4-)]和-lgc(C2O42-)关系如图所示,下列说法错误的是( )
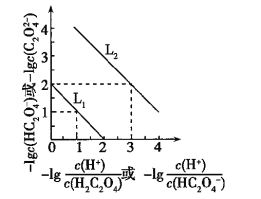
A. Ka1(H2C2O4)=1×10-2
B. 滴定过程中,当pH=5时,C(Na+)-3C(HC2O4-)>0
C. 向1 mol/L的H2C2O4溶液中加入等体积等浓度的NaOH溶液,完全反应后显酸性
D. 向0.1 mol/L的H2C2O4溶液中加水稀释,C(HC2O4-)/C(H2C2O4)比值将增大
【答案】B
【解析】
二元弱酸的电离平衡常数![]() ,斜线
,斜线![]() 表示c(H+)/c(H2C2O4)与c(HC2O4-)的乘积等于1×10-2,斜线
表示c(H+)/c(H2C2O4)与c(HC2O4-)的乘积等于1×10-2,斜线![]() 表示c(H+)/c(HC2O4-)与c(C2O42-)的乘积等于1×10-5。
表示c(H+)/c(HC2O4-)与c(C2O42-)的乘积等于1×10-5。
A、根据图示,Ka1(H2C2O4)=![]() =1×10-2,故A正确;
=1×10-2,故A正确;
B、根据电荷守恒C(Na+)+ C(H+)= c(HC2O4-)+2c(C2O42-)+ c(OH-),根据图示,Ka2(H2C2O4)=![]() ,当pH=5时,c(HC2O4-)=c(C2O42-),所以C(Na+) -3C(HC2O4-)= c(OH-)- C(H+)=
,当pH=5时,c(HC2O4-)=c(C2O42-),所以C(Na+) -3C(HC2O4-)= c(OH-)- C(H+)=![]() ,故B错误;
,故B错误;
C、向1 mol/L的H2C2O4溶液中加入等体积等浓度的NaOH溶液,溶液中的溶质是NaHC2O4,HC2O4-电离平衡常数是1×10-5、水解平衡常数是![]() ,所以,草酸氢根离子的电离常数大于其水解常数,因此该溶液呈酸性,故C正确;
,所以,草酸氢根离子的电离常数大于其水解常数,因此该溶液呈酸性,故C正确;
D、Ka1(H2C2O4)=![]() ,向0.1 mol/L的H2C2O4溶液中加水稀释,氢离子浓度减小,K不变,所以C(HC2O4-)/C(H2C2O4)比值将增大,故D正确。
,向0.1 mol/L的H2C2O4溶液中加水稀释,氢离子浓度减小,K不变,所以C(HC2O4-)/C(H2C2O4)比值将增大,故D正确。


科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol NH3气体(假设生成气体完全逸出),同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体(已知难溶性碱受热易分解,生成相应的金属氧化和水,如 M(OH)n![]() MOn/2+n/2H2O向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中 ( )
MOn/2+n/2H2O向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中 ( )
A. 至少存在3种离子
B. CO32-、K+—定不存在
C. SO42-、NH4+、Fe3+一定存在,Cl-可能不存在
D. Cl- 一定存在,且 n (Cl-) ≥0.04mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化性强弱:Cl2>Br2>Fe3+;还原性强弱:Fe2+>Br->Cl-
(1)下列反应能够发生的是:___(可多选);
A.Cl2+2Fe2+=2Cl-+2Fe3+ B.2Cl-+Br2=Cl2+2Br-
C.Br2+2Fe2+=2Br-+2Fe3+ D.2Fe3++2Br-=2Fe2++Br2
(2)把少量的氯气通入FeBr2溶液中时,氯气可以氧化Fe2+和Br-,请问氯气先氧化哪一种离子?___(填写离子符号);
(3)往250mLFeBr2溶液中通入8.96LCl2(标准状况),反应完成后,溶液中1/2的Br-被氧化为溴单质,则原FeBr2溶液的物质的量浓度为多少?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有氯气的三个集气瓶中,分别注入约五分之一的液体并振荡,观察下图所记录的现象,其中判断各瓶所注入的液体正确的是( )

A. ①中为硝酸银溶液B. ②中为氢氧化钠溶液
C. ③中为蒸馏水D. ③中为澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁条,再滴入5 mL的稀盐酸。
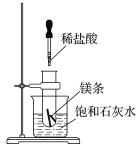
回答下列问题:
(1)实验中观察到的现象是____________________________________________。
(2)产生上述现象的原因是_________________________________________________。
(3)写出有关反应的离子方程式_________________________________________。
(4)由实验推知,MgCl2溶液和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图所示(未表示出原子或原子团的空间排列)。该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是
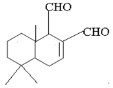
A. H2
B. Ag(NH3)2OH溶液
C. HBr
D. Br2的CCl4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用酸性KMnO4和H2C2O4反应来探究“外界条件对化学反应速率的影响”。 实验时,先分别量取KMnO4酸性溶液、H2C2O4溶液,然后倒入大试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。
(1)已知草酸H2C2O4是一种二元弱酸,写出草酸的电离方程式______________、_____________。
某同学设计了如下实验:
实验编号 | H2C2O4溶液 | KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||
a | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
b | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
c | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(2)探究浓度对化学反应速率影响的组合实验编号是__________,可探究温度对化学反应速率影响的实验编号是__________。
(3)实验a测得混合后溶液褪色的时间为40s,忽略混合前后体积的微小变化,则这段时间内的平均反应速率v(KMnO4)=______ mol·L-1·min-1。
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快,褪色速率后来加快的原因可能是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,11.2L CH4与H2的混合气体恰好与11.2L O2完全反应生成CO2和H2O,则原混合气体中的平均相对分子质量为( )
A. 5.56B. 6.67C. 11.12D. 9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com