
| A. | Na、K--遇湿易燃物品 | B. | TNT、NH4NO3--爆炸品 | ||
| C. | CH4、C2H5OH--易燃气体 | D. | 浓H2SO4、浓HNO3--腐蚀品 |
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 25℃时,CuS的溶解度大于ZnS的溶解度 | |
| B. | 25℃时,向含有等物质的量的FeCl2、CuCl2的混合液中逐滴加入Na2S,最先出现沉淀的是FeS | |
| C. | 除去ZnCl2溶液中的Cu2+,可以选用FeS作沉淀剂 | |
| D. | 将足量CuSO4溶解在0.1 mol/L的H2S溶液中,S2-能达到的最大浓度为$\sqrt{1.3}$×10-18mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
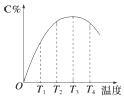 (1)估计下列各变化过程是熵增还是熵减.
(1)估计下列各变化过程是熵增还是熵减.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性HX<HY | |
| B. | 结合H+的能力Y->CO32->X->HCO3- | |
| C. | 溶液的碱性NaX>Na2CO3>NaY>NaHCO3 | |
| D. | HX和HY酸性相同,但比H2CO3弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、SO42-、NO3- | B. | Na+、K+、Br -、AlO2- | ||
| C. | Na+、NO3-、Cl-、SO42- | D. | Na+、K+、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小:W>Z>Y | |
| B. | 简单气态氢化物的热稳定性:W>X | |
| C. | Y、Z、W最高价氧化物对应水化物能够两两发生反应 | |
| D. | 简单离子的还原性:X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
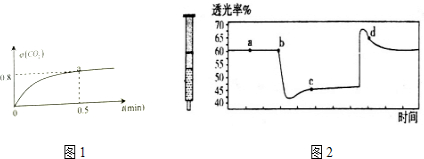
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com