
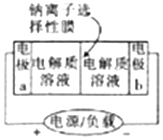
 如图是一种正在投入生产的大型蓄电池系统的原理图,电池中的左右两侧为电极,中间为钠离子选择性膜(电池放电和充电时该膜只允许钠离子通过),电池充、放电时反应的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.下列关于此电池的说法正确的是( )
如图是一种正在投入生产的大型蓄电池系统的原理图,电池中的左右两侧为电极,中间为钠离子选择性膜(电池放电和充电时该膜只允许钠离子通过),电池充、放电时反应的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.下列关于此电池的说法正确的是( )| A. | 电极a接触到的电解质溶液为Na2S2-Na2S4混合溶液 | |
| B. | 放电过程中.钠离子从电极b通过钠离子选择性膜移动到电极a | |
| C. | 电池放电时,负极的电极反应式为3Br--2e-=Br3- | |
| D. | 充电过程中,当有0.1molNa+通过钠离子选择性膜时.导线中通过0.2mol电子 |
分析 根据总反应2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr可知放电过程时,S元素的化合价从-1价上升到-$\frac{1}{2}$价,Br元素的化合价从-$\frac{1}{3}$价降到-1价,则放电时负极反应为2S22--2e-=S42-,正极反应为Br3-+2e-=3Br-;充电时与放电相反,电池充电时外接电源的正极与电池的正极相连,负极与负极相连,则a电极为正极,b电极为负极,据此解答.
解答 解:A.a电极为正极,正极反应为Br3-+2e-=3Br-,则电极a接触的电解质溶液应为NaBr3和NaBr的混合溶液,故A错误;
B.由图可知给电池充电时外接电源的正极与电池的正极相连,负极与负极相连,则a电极为正极,b电极为负极,放电过程为原电池,阳离子向正极移动,则放电过程中钠离子从电极b通过钠离子选择性膜移动到电极a,故B正确;
C.电池放电时,负极失电子发生氧化反应,电极反应式为2S22--2e-=S42-,故C错误;
D.有0.1molNa+通过离子交换膜,说明有0.1mol电子转移,导线通过0.1mol电子,故D错误;
故选B.
点评 本题考查了原电池和电解池工作原理的应用,注意从元素化合价的升降来把握电极的判断方法和电极反应的书写是解题的关键,题目难度较大.


科目:高中化学 来源: 题型:选择题
| 选项 | 陈述I | 陈述II |
| A | 除去苯中的苯酚杂质,向其中加入足量的溴水,过滤 | 苯酚与溴水反应生成难溶于水的沉淀,故可过滤除去 |
| B | 醋酸加入到碳酸钠固体中,将产生的气体通入C2H5ONa中,溶液变浑浊 | 可证明酸性:CH3COOH>H2CO3>C2H5OH |
| C | 将CH3CH2Br与NaOH 乙醇溶液共热产生的气体通入溴水中,溶液褪色 | 可证明该反应产生乙烯 |
| D | 氯乙烷中加入NaOH溶液共热,冷却后滴入AgNO3溶液,有白色沉淀生成 | 可证明氯乙烷中有氯元素存在 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 稀HNO3氧化能力弱于浓HNO3 | |
| C. | 贮存铵态氮肥时要密封保存,并放在阴凉处 | |
| D. | 硝酸只能被Zn、Fe等金属还原成H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
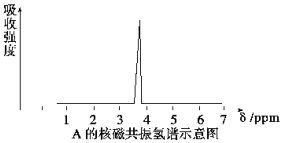 (1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图所示,则A的结构简式为CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).
(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图所示,则A的结构简式为CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n | |
| B. | 等质量的烃CxHy完全燃烧耗氧量的多少取决于y/x的值的大小,y/x的值越大,耗氧量越多 | |
| C. | 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减少,则y<4;否则y>4 | |
| D. | 质量相同的两种有机物完全且充分燃烧产生等量的二氧化碳,则这两种有机物中碳元素的质量分数一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数之和是质子数之和两倍的水分子符号可能是D${\;}_{2}^{16}$O | |
| B. | Mg的原子结构示意图为 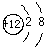 | |
| C. | 次氯酸的电子式为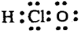 | |
| D. | 少量氢氧化钙溶液与碳酸氢钠溶液混合:OH-+HCO3一═H2O+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com