
【题目】从煤的干馏产品之一煤焦油中可分离出蒽(![]() ),再经升华提纯得到的高纯度蒽可用作闪烁计数器的闪烁剂。下列关于蒽的说法错误的是
),再经升华提纯得到的高纯度蒽可用作闪烁计数器的闪烁剂。下列关于蒽的说法错误的是
A. 化学式为C14H10
B. 一定条件下能发生取代、加成、氧化等反应
C. 具有12种二氯代物
D. 与菲( )互为同分异构体
)互为同分异构体
【答案】C
【解析】
![]() 为稠环芳烃,结构左右对称,含有3种不同的H原子,具有苯的性质,以此解答该题。
为稠环芳烃,结构左右对称,含有3种不同的H原子,具有苯的性质,以此解答该题。
A.根据蒽的结构简式可知其化学式为C14H10,A正确;
B.含有苯环,具有苯的性质,可发生取代、加成、氧化等反应,B正确;
C.蒽分子是高度对称结构,如图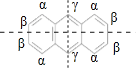 关于虚线对称,有如图三种H原子,二元氯代,若为取代α位2个H原子有3种;若为取代β位2个H原子有3种;若为取代γ位2个H原子有1种;若为取代α-β位H原子有4种;若为取代α-γ位H原子有2种,若为取代β-γ位H原子有2种,故共有3+3+1+4+2+2=15,C错误;
关于虚线对称,有如图三种H原子,二元氯代,若为取代α位2个H原子有3种;若为取代β位2个H原子有3种;若为取代γ位2个H原子有1种;若为取代α-β位H原子有4种;若为取代α-γ位H原子有2种,若为取代β-γ位H原子有2种,故共有3+3+1+4+2+2=15,C错误;
D.与 的分子式相同,但结构不同,互为同分异构体,D正确;
的分子式相同,但结构不同,互为同分异构体,D正确;
故合理选项是C。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】环己酮是重要的化工原料,也是重要的工业溶剂。实验室制备环己酮的原理、有关数据及装置示意图如下:
反应原理:

反应放热,温度过高或者重铬酸钠过量会进一步氧化.
主要物料及产物的物理参数:
名称 | 溶解度 | 密度 | 熔点℃ | 沸点℃ | 溶解度 | |
水 | 乙醚 | |||||
环己醇 | 无色,有刺激性气味 | 0.9624 | 25.93 | 161.5 | 5.67g/100mL |
|
环己酮 | 无色,有枣激性气味 | 0.9478 | —— | 155.7 | 2.4g/100mL |
|
实验装置:

实验步骤:
①投料:在100mL三颈烧瓶中加入20mL水,慢慢加入5mL浓硫酸摇动,振荡下缓慢加入5mL(4.8g,0.048mol)环己醇,并将混合液温度降至30℃以下。将5g(0.019mol)重铬酸钠溶于水得橙红色溶液备用.
②反应:将约1/5的重铬酸钠溶液加入三颈烧瓶中,充分搅拌使之混合均匀。冷水浴冷却,控制反应温度在55-60℃。待橙红色消失后,再将剩余的重铬酸钠溶液分四次加入到三颈烧瓶中,当温度自动下降时,加入4mL甲醇使反应液完全变成墨绿色(三价铬);
③蒸馏:在反应瓶中加入30mL水,并改为蒸馏装置,收集90-99℃之间的馏分(环己酮与水的共沸物)至无油珠为止;
④萃取、干燥:将馏出液用食盐饱和后转入分液漏斗中,分出有机层。水层用8mL乙醚提取一次,将乙醚提取液和有机层合并,用无水硫酸镁干燥;5.蒸馏,收集环己酮产品2.6g。
请回答下列问题:
(1)装置A的名称是
(2)完成并配平反应方程式:
_____![]() +_____Na2Cr2O7+____H2SO4→____
+_____Na2Cr2O7+____H2SO4→____![]() +____Na2SO4+____Cr2(SO4)3+___H2O___________
+____Na2SO4+____Cr2(SO4)3+___H2O___________
(3)反应过程中加入甲醇后有无色气体生成。加入甲醇的作用是______,请用离子方程式表示反应原理________.
(4)步骤4向馏出液加入食盐的目的是_________,将乙醚提取液和有机层合并的原因是_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. PH4+、 PO43-、XeO4 的空间构型均为正四面体形
B. CO32-、 NO3-、CH2O的空间构型均为平面三角形
C. NH2-、NF3、Cl2O、 I3- 的VSEPR 模型名称均为四面体形
D. 微粒 N2H5、 NH4 、Fe(CO)3、Fe(SCN)3、H3O+、[Ag(NH3)2]OH 中均含有配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的说法正确的是( )
A. IA族的元素全部是金属元素
B. 第一、二、三周期三个周期所含元素种类较少,称为短周期,只包括主族元素,不包括副族元素
C. 元素周期表是元素周期律的具体表现形式
D. 0族元素原子的最外层电子数均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是关于农作物A、B在相同土壤中N、P、K三元素肥效实验的结果记录,“+”表示施肥,“―”表示未施肥)。请据表中的数据,判断正确的结论是( )

A. 对于农作物A来说,其生长发育不需要N元素
B. 对农作物A来说,施肥时最重要的是施加P肥
C. 对农作物B来说,三种元素中K最重要
D. 两种农作物对土壤中N、P、K的需求量基本相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长征三号甲运载火箭(CZ—3A)与“嫦娥工程“太空摆渡车”“北斗卫星”“风云卫星”等中国航天大事件紧密相连。它是大型三级液体推进剂火箭,一子级和二子级均使用偏二甲肼(UDMH)-四氧化二氮(NTO)推进剂,反应产物绿色无污染。回答下列问题:
(1)已知(CH3)2NNH2(l)+4O2(g)= 2CO2(g)+4H2O(g)+N2(g) △H=a kJ/mol
N2(g)+O2(g)= 2NO(g) △H=b kJ/mol
2NO(g)+O2(g)= N2O4(l) △H=c kJ/mol
则UDMH-NTO推进剂反应的热化学方程式为________________________。
(2)偏二甲肼易溶于水,其一水合物的电离方式与一水合氨(Kb=1.7×10-5)相似但电离常数更小,偏二甲肼一水合物的电离方程式为___________________,向偏二甲肼溶液中加入等物质的量的醋酸(Ka=-1.7×10-5),充分反应后溶液呈______(填“酸性”“碱性”或“中性”)。碱性偏二甲肼—空气燃料电池的电解质溶液是20~30%的KOH溶液,电池工作时正极的电极反应式为__________________________。
(3)N2O4是NO2的二聚产物,NO、NO2等氮氧化物是主要的大气污染物,氮氧化物与悬浮在大气中的微粒相互作用时,涉及如下反应:
(I)2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) △H1<0 K1
NaNO3(s)+ClNO(g) △H1<0 K1
(II)2NO(g)+Cl2(g)![]() 2ClNO(g) △H2<0 K2
2ClNO(g) △H2<0 K2
则4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+C12(g)的平衡常数为_______(用K1、K2表示);为研究不同条件对反应(Ⅱ)的影响,T℃时,向2L恒容密闭容器中加入0.2mol NO和0.2mol C12,5min时达到平衡,反应过程中容器内的压强减小了10%,则5min内反应的平均速率v(C1NO)=_____mol/(L·min),NO的平衡转化率α1=_____%;若其他条件保持不变,使反应(Ⅱ)在初始容积为2L的恒压密闭容器中进行,则NO的平衡转化率α2_______α1(填“>”“<”或“=”)。
2NaNO3(s)+2NO(g)+C12(g)的平衡常数为_______(用K1、K2表示);为研究不同条件对反应(Ⅱ)的影响,T℃时,向2L恒容密闭容器中加入0.2mol NO和0.2mol C12,5min时达到平衡,反应过程中容器内的压强减小了10%,则5min内反应的平均速率v(C1NO)=_____mol/(L·min),NO的平衡转化率α1=_____%;若其他条件保持不变,使反应(Ⅱ)在初始容积为2L的恒压密闭容器中进行,则NO的平衡转化率α2_______α1(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问题。
(1)Cu2+的未成对电子数有______个,H、O、S电负性由大到小的顺序为_______。
(2)在硫酸铜溶液中滴加过量氨水可形成[Cu(NH3)4]SO4蓝色溶液。[Cu(NH3)4]SO4中化学键类型有_______,阴离子中心原子杂化类型为______。
(3)铁铜合金晶体类型为_____;铁的第三(I3)和第四(I4)电离能分别为2957kJ/mol、5290kJ/mol,比较数据并分析原因________________。
(4)金铜合金的一种晶体结构为立方晶型,如图所示。已知该合金的密度为dg/cm3,阿伏加德罗常数值为NA,两个金原子间最小间隙为apm(1pm=10-10cm)。则铜原子的半径为_______cm(写出计算表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A. 1mol![]() Yb(镱)中含有的中子数为70NA
Yb(镱)中含有的中子数为70NA
B. 常温下,1LpH=13的Ba(OH)2溶液中由水电离的OH-数目为0.1NA
C. 在锌锰碱性电池中消耗13.0g负极材料,转移电子数为0.2NA
D. 常温常压下,28.0g丙烯和乙烯的混合气体中含有的氢原子数为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com