
为确定某溶液的离子组成,进行如下实验:①测定溶液的pH,溶液显强碱性;②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的气体;③在②中溶液中再滴加Ba(NO3)2溶液,产生白色沉淀;④取③中上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。根据实验现象,以下推测正确的是( )
A.一定有SO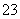
B.一定有CO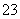
C.一定有Cl-
D.不能确定HCO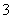 是否存在
是否存在
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
硫—碘循环分解水制氢主要涉及下列反应 :
:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
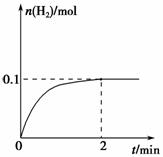 (2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
0~2 min内的平均反应速率
v(HI)=________。该温度下,
H2(g)+I2(g) 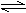 2HI(g)的平衡常数K=________。
2HI(g)的平衡常数K=________。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应起了氮的固定作用的是( )
A.N2和H2在一定条件下反应生成NH3
B.NH3经催化氧化生成NO
C.NO和O2反应生成NO2
D.由NH3制碳铵或氯铵
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸在反应中的价态变化:向铜片中加入浓硝酸,回答下列问题:
(1)开始阶段实验现象为:____________________ ______________。
反应的化学方程式为:__________________________________。
(2)若铜有剩余,则临近结束时的反应方程式为:________________________________________________________________________。
(3)当反应结束后,若通过分液漏斗向烧瓶内再加入稀盐酸,又可继续反应,产生无色无味的气体,此时的离子方程式可表示为:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作正确的是( )
A.当某实验没有明确的药品用量说明时,为看到明显现象,取用药品越多越好
B.取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,使液体缓缓地倒入试管中
C.胶头滴管取完一种试液后,直接取用另一种不与其反应的试液
D.取用粉末状固体或固体颗粒时,应用药匙或纸槽,取用块状固体时,应用镊子夹取
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氯化铁溶液和氢氧化铁胶体的说法中,正确的是( )
|
| A. | 两种分散系均呈红褐色 | B. | 分散质粒子均能透过半透膜 |
|
| C. | 分散质粒子直径均在1﹣100nm之间 | D. | 可用丁达尔效应加以鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol•L﹣1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)Na2CO3固体中混有少量NaHCO3固体,除去的方法是 ,化学方程式为 .
(2)NaHCO3溶液中混有少量Na2CO3,除去的方法是 ,反应的离子方程式为 .
(3)NaOH溶液中混有少量Na2CO3,除去的方法是 ,反应的离子方程式为 .
(4)CO2中混有少量的SO2,除去的方法是 ,反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
煤气化是有效利用化石能源手段之一,有关反应如下:
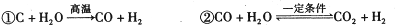 |
获得的气体称为水煤气。某研究性学习小组为探究气体的成分进行了如下实验:
【实验】使水蒸气通过灼热的焦炭,收集反应后流出的气体。
【提出假设】对气体的成份提出了三种假设。
假设1:该气体是CO、H2 假设2:该气体是C0、H2、H20。(
⑴假设3: ______________________________________
【设计实验方案,验证假设】
他们拟用T图中提供的仪器,选择必要的试剂,设计一个实验,验证上述假设(加热装置和导管等在图中略去,实验前P置内部的空气已经排尽)。
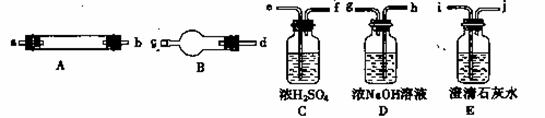
(2 )按气流从左至右连接各仪器,用题中小写字母表示接口连接顺序(仪器可重复使用)混合气
→dc →_______→_______→ij →_______→_______→_______→ij;
(3) 仪器A中需加入试剂的是____________,其中反应的化学方程式是
______________________________________________________________;
(4) 仪器B中需加入试剂的名称是_______________,其作用是_________________________;
(5)本实验的尾气需要处理,处理的方法为:____________________________________,
(6) 某同学认为增加焦炭的量可以提高化学反应①的速率,你是否同意他的说法,并简述理由___________________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com