
 CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:| 实验编号 | 温度 | 0 | 10 | 20 | 40 | 50 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
分析 (1)根据实验1、2的不同点确定实验目的;
(2)根据温度对反应速率的影响判断,转化率=反应的甲烷的量与总的甲烷的量的比;
(3)根据平衡常数定义可知,平衡常数等于生成物浓度系数次幂之积除以反应物浓度系数次幂之积,据此计算a;
(4)根据温度、压强对反应速率、到达平衡的时间、二氧化氮的转化率的影响分析.
解答 解:(1)实验中只有温度不同,所以实验目的是:研究温度对该化学平衡的影响,故答案为:研究温度对该化学平衡的影响;
(2)对比实验1知,40时该反应已经达到平衡状态,温度越高,反应速率越大,反应到达平衡的时间越短,所以40时实验2已经达到平衡状态,甲烷的转化率=$\frac{(0.5-0.15)mol}{0.5mol}$=70%,
故答案为:是;温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态.可确定40min时反应已经达平衡状态;70%;
(3)设二氧化氮的物质的量为a,
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)
C0(mol/L):0.5 a 0 0 0
△C(mol/L):0.40 0.80 0.40 0.40 0.80
C平(mol/L):0.10 a-0.80 0.40 0.40 0.80
则:$\frac{0.40×0.40×(0.80){\;}^{2}}{0.10×(a-0.80)}$,a=1.2
答:a的值为1.2;
(4)相同温度下,压强越大反应速率越大,反应到达平衡的时间越短,但二氧化氮的转化率越小,相同压强下,温度越高反应速率越大,反应到达平衡的时间越短,二氧化氮的转化率越小,所以其图象为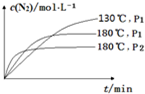 ,
,
答:图象为 .
.
点评 本题考查化学平衡的判断、外界条件对反应速率及化学平衡的影响、盖斯定律等知识点,根据方程式的特点判断平衡移动方向,难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.022mol•L-1 | B. | 0.045mol•L-1 | C. | 0.8mol•L-1 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)氨在国民经济中占有重要地位.
(1)氨在国民经济中占有重要地位.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
温度/℃ 时间/min | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫可广泛用于食品的增白 | |
| B. | 聚乙烯塑料制品可用于食品的包装 | |
| C. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| D. | 氧化铝是冶炼金属铝的原料,也是一种较好的耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com