
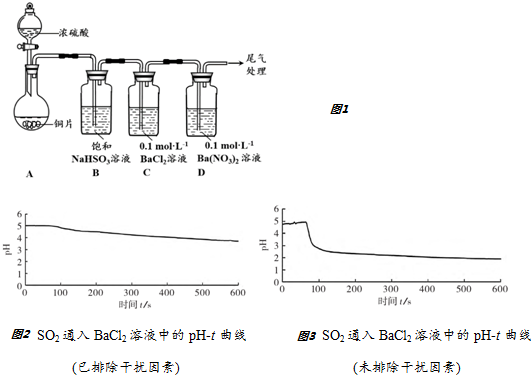
分析 装置A:加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水;装置B:为除去反应中带出的雾状硫酸,可以将气体通过NaHSO3溶液;装置C:检验C中二氧化硫在溶液中生成亚硫酸,亚硫酸被氧气氧化成硫酸,白色沉淀为硫酸钡,装置D:检验酸性条件下,硝酸根离子具有氧化性,NO3-氧化了SO2,生成硫酸钡沉淀,最后进行尾气处理.
(1)为防止A中挥发出的硫酸对CD装置实验的干扰,需用饱和的亚硫酸氢钠除去硫酸蒸气;
(2)C、D中加入足量稀盐酸,白色沉淀均不溶解,沉淀为硫酸钡;
(3)图2中pH下降曲线比较平缓,可能为二氧化硫和水反应生成亚硫酸,亚硫酸电离导致PH下降;图3中PH下降曲线属于斜率较大的情况,可能为弱酸亚硫酸被氧化成强酸硫酸所致;
(4)D中产生白色沉淀为硫酸钡,可能为酸性条件下,SO2被O2氧化或被NO3-氧化生成SO42-;排除SO2被O2氧化需排除装置中的氧气,用硝酸钡和二氧化硫进行反应论证;
(5)NO3-、O2氧化二氧化硫的能力不同,据此分析解答.
解答 解:(1)装置A:加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水;浓硫酸的沸点为338℃,加热时酒精灯火焰的温度为400℃~500℃”,说明浓硫酸在温度较高时也能挥发出H2SO4蒸气,C、D中有可能是挥发出的H2SO4提供的SO42-与Ba2+反应生成BaSO4:SO42-+Ba2+═BaSO4↓,需排除,所以用饱和的亚硫酸氢钠溶液吸收吸收装置A中产生的H2SO4酸雾,
故答案为:吸收装置A中产生的H2SO4酸雾;
(2)由白色沉淀,发现均不溶于稀盐酸,白色沉淀为硫酸钡,装置C:可能是溶液中溶解的氧气与SO2作用产生了硫酸,进而得到BaSO4:2Ba2++2SO2+O2+2H2O═2BaSO4↓+4H+,
装置D:可能是硝酸根离子具有氧化性,NO3-氧化了SO2,生成硫酸钡沉淀,3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+,
故答案为:BaSO4;
(3)图2中pH下降曲线比较平缓,可能为二氧化硫和水反应生成亚硫酸,亚硫酸电离导致PH下降,反应方程式为:SO2+H2O?H2SO3?H++HSO3-;图3中PH下降曲线属于斜率较大的情况,可能为弱酸亚硫酸被氧化成强酸硫酸所致,反应方程式为:2SO2+2H2O+O2═2SO42-+4H+,
故答案为:SO2+H2O?H2SO3?H++HSO3-;2SO2+2H2O+O2═2SO42-+4H+;
(4)酸性条件下,SO2被O2氧化成+6价的硫,在溶液中硫酸根离子和钡离子形成沉淀,也可能为SO2被NO3-氧化生成SO42-,为排除氧气的干扰,可在排除O2干扰前提下,向盛有等体积0.1 mol•L-1Ba(NO3)2溶液的洗气瓶D中通入SO2,若出现白色沉淀,则证明酸性条件下NO3-氧化了SO2,反之则说明原D洗气瓶中沉淀的出现是O2氧化SO2所致,
故答案为:酸性条件下,SO2被O2氧化;被NO3-氧化生成SO42-;在排除O2干扰前提下,向盛有等体积0.1 mol•L-1Ba(NO3)2溶液的洗气瓶D中通入SO2,若出现白色沉淀,则证明酸性条件下NO3-氧化了SO2,反之则说明原D洗气瓶中沉淀的出现是O2氧化SO2所致;
(5)不同的氧化剂对同一还原剂氧化能力不同,小组同学设计此实验方案想进一步探究可能为若NO3-和O2均参与反应,则相同条件下二者氧化SO2的能力或反应速率的差异等,
故答案为:若NO3-和O2均参与反应,则相同条件下二者氧化SO2的能力或反应速率的差异等.
点评 本题本题是以研究SO2的性质为载体考查实验方案的评价及性质实验方案的设计,注意把握装置的作用及发生的反应是解答的关键,题目难度中等,培养了学生灵活运用知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | HA较强 | B. | HB较强 | C. | 两者一样 | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3•H2O |
| B | Na+、OH-、Cl- | 少量Mg(HCO3)2溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
| C | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2 355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| X | Y | ||
| W | Q |
| A. | 简单离子半径大小关系为:W>Z>Y | |
| B. | 核外最外层电子数:Q>Y>X>W>Z | |
| C. | X与氢元素形成的化合物中,只含极性键 | |
| D. | 常见单质的熔沸点:X>W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 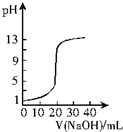 图表示0.10 mol•L-1 NaOH溶液滴定20.00 mL 0.10 mol•L-1醋酸溶液的滴定曲线 | |
| B. | 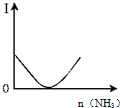 图表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 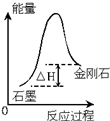 根据图所示可知:金刚石生成石墨为放热反应 | |
| D. | 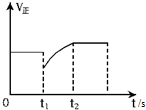 图表示反应2SO2+O2?2SO3,t1时刻只小了的SO3的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z | B. | 氧化物的熔点:Z>X | ||
| C. | 简单氢化物稳定性:Z>Y | D. | X、Y、Z单质的晶体类型可能有三种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
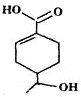
| A. | 分子中含有四种官能团 | |
| B. | 1mol该有机物完全燃烧消耗O2的物质的量为10mol | |
| C. | 能发生加成、取代、消去、水解等反应 | |
| D. | 相同条件下,等量的该有机物分别与足量的Na和NaHCO3溶液反应产生的气体的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b、c与a形成化合物的稳定性一定为c>b | |
| B. | a和d形成的化合物与水反应产生气体可以作燃料 | |
| C. | c、a和b可形成的化合物为离子化合物 | |
| D. | a、b、c、d四种元素组成的化合物的水溶液可以为酸性、也可以为碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com