
【题目】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,不正确的是( )
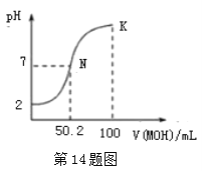
A.HA的电离方程式为:HA=H++A- B.MOH为一元弱碱
C.K点对应的溶液中有:c(MOH)+c(M+)=0.02mol ![]() L-1 D.N点对应的溶液中有:c(M+)=c(A-)
L-1 D.N点对应的溶液中有:c(M+)=c(A-)
【答案】C
【解析】
A.由图可知,0.01mol/LHA溶液中,pH=2,则溶液中c(H+)=0.01mol/L,说明HA为强酸,在水中完全电离,因此其电离方程式为![]() ,故A说法正确;
,故A说法正确;
B.由图可知,当溶液的pH=7时,加入MOH溶液的体积为50.2mL,此时溶液中溶质为MA和MOH,溶液显中性,说明溶液中存在M+的水解,因此MOH为弱碱,故B项说法正确;
C.K点溶液中加入MOH溶液的体积为100mL,此时混合溶液的体积变为原溶液的两倍,则浓度变为原来的一半,结合物料守恒可得c(MOH)+c(M+)=0.01mol/L,故C说法错误;
D.N点溶液的pH=7,则溶液中c(H+)=c(OH-),由电荷守恒![]() 可知,c(M+)=c(A-),故D说法正确;
可知,c(M+)=c(A-),故D说法正确;
故答案为C。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列有机反应类型中,不正确的是
A.![]() +HNO3
+HNO3![]() +H2O取代反应
+H2O取代反应
B.CH3CH3+Cl2![]() CH3CH2Cl+HCl置换反应
CH3CH2Cl+HCl置换反应
C.CH2=CH2+H2O![]() CH3CH2OH加成反应
CH3CH2OH加成反应
D.2CH3CHO+O2![]() 2CH3COOH氧化反应
2CH3COOH氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A. 该溶液的pH=4 B. 升高温度,溶液的pH和电离平衡常数均减小
C. 此酸的电离平衡常数约为1×10-7 D. 加入少量纯HA,电离程度减小电离平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项反应对应的图像正确的是( )
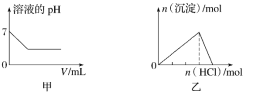
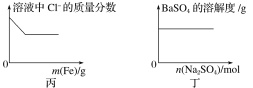
A.图甲为25℃时,向亚硫酸溶液中通入氯气
B.图乙为向NaAlO2溶液中通入HCl气体
C.图丙为向少量氯化铁溶液中加入铁粉
D.图丁为向BaSO4饱和溶液中加入硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见的某反应的化学方程式为a+b→c+d+H2O(未配平,条件略去)。下列叙述不正确的是( )
A. 若a是铁,b是稀硝酸(过量),且a可溶于c溶液中。则a与b反应的离子方程式为 Fe+4H++NO3-=Fe3++NO↑+2H2O
B. 若c,d均为气体,且都能使澄清石灰水变浑浊,则将混合气体通入溴水中,橙色褪去,其褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
C. 若c是无色刺激性气味的气体,其水溶液呈弱碱性。在标准状况下用排空气法收集c气体得平均摩尔质量为20g·mo1-1的混合气体进行喷泉实验。假设溶质不扩散,试验完成后所得溶液的物质的量浓度约为0.056mo1·L-1
D. 若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5,则上述反应的离子方程式为4CO2+5OH-=CO32+3HCO3-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”。引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气。
I、用NH3催化还原NOx可以消除氮氧化物的污染。反应原理为:NO(g)+NO2(g)+2NH3(g) ![]() 2N2(g)+3H2O(g)。
2N2(g)+3H2O(g)。
(1)该反应的△S________0(填“>”、“=”或“<”)。
(2)II、已知反应N2O4(g) ![]() 2NO2(g) △H,随温度升高,混合气体的颜色变深。将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况。下列说法能说明透光率不再发生改变的有________。
2NO2(g) △H,随温度升高,混合气体的颜色变深。将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况。下列说法能说明透光率不再发生改变的有________。
a.气体颜色不再改变b.△H不再改变
c.v正(N2O4)=2v逆(NO2)d.N2O4的转化率不再改变
(3)III、用CH4催化还原NOx也可以消除氮氧化物的污染。
已知:CH4(g)的标准燃烧热为-890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1114 kJ/mol
2NO(g)+O2(g)=2NO2(g)△H=﹣114 kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式:________。
(4)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
温度/℃ | 0 | 10 | 20 | 40 | 50 |
T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
①温度为T1℃时,0~20min内,v(CH4)=________。
②温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH为2的氢氟酸稀释100倍后,pH<4。则250C时,将0.1mol·L-1的HF加水不断稀释,下列表示的量保持不变的是( )
①n(H+); ②c(H+)·c(OH—);③c(OH—)+ c(F—);④![]() ⑤
⑤![]() ;
;
A.①③④B.②③④C.③④⑤D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是( )
A.在平衡体系PCl5(g)![]() PCl3(g)+Cl2(g)中加入一定量的37Cl2,一段时间后37Cl存在于五氯化磷、三氯化磷和氯气这三种物质中
PCl3(g)+Cl2(g)中加入一定量的37Cl2,一段时间后37Cl存在于五氯化磷、三氯化磷和氯气这三种物质中
B.CH3COOH与H18O-CH2CH3发生酯化反应是可逆反应,达到平衡后,18O一定仅存在于乙醇和乙酸乙酯分子里,不可能存在于乙酸和水分子里
C.在氧气中完全燃烧后生成物只有CO2和H2O的有机物一定是烃
D.CH2Cl2没有同分异构体的事实证明了甲烷分子是以碳原子为中心的正四面体结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com