
【题目】乙酸乙酯和丁酸互为同分异构体,下列方法中不能对二者进行鉴别的是( )
A.利用金属钠
B.利用质谱法
C.利用红外光谱法
D.利用核磁共振氢谱
科目:高中化学 来源: 题型:
【题目】有机物G是一种“β﹣兴奋剂”,其合成路线如下: 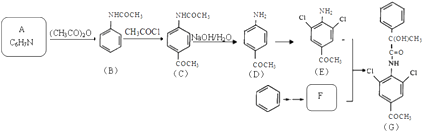 已知:
已知: 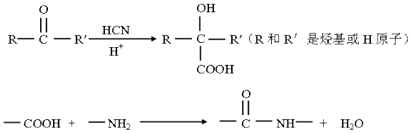
(1)写出化合物E同时符合下列条件的所有同分异构体的结构简式
①红外光谱显示含有三种官能团,其中无氧官能团与E相同,不含甲基
②1H﹣NMR谱显示分子中含有苯环,且苯环上只有一种不同化学环境的氢原子.
③苯环上只有4个取代基,能发生银镜反应
(2)下列说法不正确的是
A.化合物B生成C的反应为取代反应
B.1mol化合物D最多与4molH2发生加成反应
C.化合物D生成E的条件为浓氯水/铁屑
D.化合物G的分子式为C17H14Cl2NO3
(3)写出E+F→G的化学方程式
(4)根据题中信息,设计以苯和CH3COCl为原料制备F的合成路线(用流程图表示,其他无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民开始使用东海天然气作为民用燃料,管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4 , 它们的燃烧反应如下:2CO+O2![]() 2CO2 2H2+O2
2CO2 2H2+O2![]() 2H2O CH4+2O2
2H2O CH4+2O2![]() CO2+2H2O
CO2+2H2O
根据以上化学方程式判断,燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是 , 因此燃烧管道煤气的灶具如果改烧天然气,灶具的改进方法是进风口(填“增大”或“减小”),如不改进可能产生的不良后果是。
管道煤气中含有的烃类,除甲烷外还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
乙烷 | 丙烷 | 丁烷 | |
熔点/℃ | -183.3 | -189.7 | -138.4 |
沸点/℃ | -88.6 | -42.1 | -0.5 |
试根据以上某个关键数据解释冬天严寒季节有时管道煤气火焰很小,并且呈断续状态的原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类:
(1)Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,将化学式分别填在表②的后面;(只需填一种)
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 | ③NaOH | ⑤Na2SO4 | ⑦SO2 | ⑨NH3 |
(2)写出⑦转化为⑧的化学方程式;
(3)写出Cu和①的浓溶液反应的化学方程式;
(4)实验室制备⑨常用和反应,检验该气体的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假如你是一位企业家,在开发海水资源的众多项目中,选择了海水提镁,在前期考察过程中你将遇到许多问题,请根据背景材料的提示,按要求回答相关问题:
材料1:下图为海水中各元素含量情况(mg/L)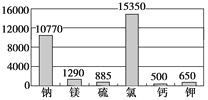
材料2:部分化学试剂的市场价格
试剂 | 氢氧化钾 | 氢氧化钠 | 氢氧化钙 | 氧化钙 |
价格(元/吨) | 5238.0 | 2300.00 | 1200.00 | 700.00 |
请回答下列问题:
(1)在海水提镁的过程中要实现对镁离子的富集、分离,有以下三个方案:
方案一:直接往海水中加入沉淀剂;
方案二:加热蒸发海水后再加入沉淀剂;
方案三:在晒盐后的卤水中加入沉淀剂。
你认为方案最合理。
不选方案的理由是。
不选方案的理由是。
(2)应该选择试剂作为镁离子的沉淀剂。不考虑其他费用,沉淀相同量的镁离子所用氢氧化钠和氧化钙的价格比为。
(3)为了节省成本,你可考虑以海边上的贝壳为原料,试简述其理由:?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有0.1molL﹣1四种溶液NaOH、NH3H2O、HCl、CH3COOH
(1)已知CH3COOH溶液的pH=3,其电离度为 , 由水电离的c(H+)=molL﹣1 .
(2)相同pH的CH3COOH溶液和HCl溶液加水稀释,其pH变化情况如图,其中表示HCl溶液的是曲线 , a、b两点中,导电能力更强的是 . 
(3)NH3H2O溶液和HCl溶液混合,已知体积V(NH3H2O)>V(HCl),当溶液中c(NH3H2O)=c(NH4+)时,溶液的pH= . [已知:Kb(NH3H2O)=1.77×10﹣5 , lg 1.77=0.25].
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是绿色氧化剂,且酸性介质下由更强的氧化性,易溶于水显弱酸性,常温下K1=1×10﹣12 , K2=1×10﹣25 , 回答下列问题:
(1)常温下水的电离平衡的常数K约为 , K、K1、K2从大到小顺序为;
(2)在硫酸亚铁存在条件下,H2O2溶液可以把苯(C6H6)氧化为苯酚(C6H5OH),反应后的混合物经过、蒸馏得到苯酚,理论上制取1mol苯酚需要消耗H2O2mol,实际消耗大于理论用量的主要原因是
(3)K4[Fe(CN)6](黄色溶液)、K3[Fe(CN)6](黄绿色溶液)与一定量H2O2组成的混合物,用酸或碱调节混合溶液的pH,会出现黄色、黄绿色交替变化,按照从酸性至碱性的顺序,可观察到的现象是;
(4)工业用H2O2除去废水中的Cl2 , 氧化产物是;与SO2除Cl2相比,其优点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000molL﹣1盐酸滴入20.00mL 1.000molL﹣1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( ) 
A.a点由水电离出的c(H+)=1.0×10﹣14mol/L
B.b点:c(NH4+)+c(NH3H2O)>c(Cl﹣)
C.b点时加入的盐酸体积小于20.00mL,而c点时加入的盐酸体积大于20.00mL
D.d点后,溶液温度略下降的主要原因是NH3H2O电离吸热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com