
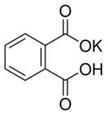
| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 | 0.4080 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 | |
| 4 | 17.00 |
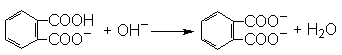 (2分)
(2分)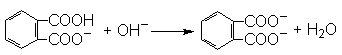


科目:高中化学 来源:不详 题型:单选题
| A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.蒸发结晶时应将溶液蒸干 |
| D.称量时,称量物放在称量纸上,置于天平左盘,砝码放在天平右盘中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用1mol的醋酸溶液和1.01mol的氢氧化钠溶液做中和热实验测得中和热的数值为57.3KJ/mol |
| B.通过实验得知在常温常压下,12g固体C和32g气体O2所具有的总能量一定大于44g气体CO2所具有的总能量 |
| C.室温下,用广泛pH试纸测得某溶液的pH为2.3 |
| D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.7mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
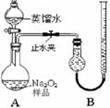
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 标准盐酸体积(mL) | 23.00 | 24.98 | 25.00 | 25.02 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
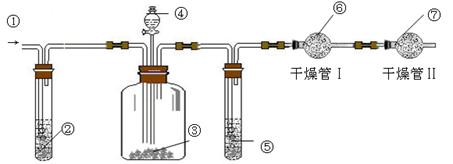
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | 0.50 | 25.95 | 25.45 |
| 2 | 25.00 | 0.30、 | | |
| 3 | 25.00 | 6.00 | 31.55 | 25.55 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
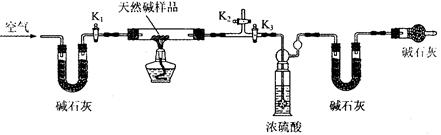
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 实验 | 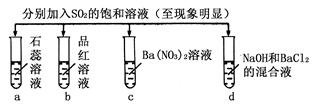 | ||||
| 记 录 | | a | b | c | d |
| A | 无色 | 不褪色 | 无色溶液 | 无色溶液 | |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 红色 | 无色 | 无色溶液 | 白色沉淀 | |
| D | 无色 | 无色 | 白色沉淀 | 无色溶液 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
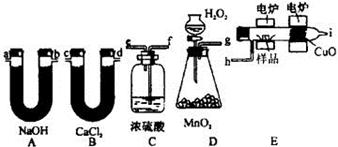
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com