
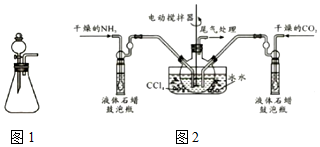
分析 利用浓氨水与氢氧化钠固体制备氨气,再将氨气和二氧化碳通入四氯化碳中,不断搅拌混合生成氨基甲酸铵,因反应是放热反应,为了防止产物因温度高分解及提高反应物的转化率,选择利用冰水进行水浴降温,
(1)装置1是利用分液漏斗滴入液体溶解锥形瓶中的固体,利用溶解放热使氨水分解生成氨气;
(2)①反应是放热反应降温平衡正向进行,液体石蜡鼓泡瓶的主要作用是控制反应进行程度,控制气体流速和原料气体的配比;
②生成的氨基甲酸铵小晶体悬浮在四氯化碳中,利用过滤得到的氨基甲酸铵(NH2COONH4)是一种白色固体,易分解,应选择低温干燥;
(3)尾气为氨气,可与稀硫酸反应;
(4)碳酸氢铵的氨基甲酸铵样品中,使碳元素完全转化为碳酸钙,依据碳元素守恒和混合物质量计算物质的量分数.
解答 解:(1)把浓氨水滴入到固体氧化钙或氢氧化钠,在溶解过程中放热使浓氨水分解生成氨气,
故答案为:浓氨水与氢氧化钠固体(CaO、碱石灰)等;
(2)①反应2NH3(g)+CO2(g)?NH2COONH4(s)+Q,是放热反应,降温平衡正向进行,温度升高;发生器用冰水冷却提高反应物质转化率,防止生成物温度过高分解,液体石蜡鼓泡瓶的作用是控制反应进行程度,控制气体流速和原料气体的配比,发生反应的仪器名称是三颈烧瓶,
故答案为:降低温度,提高反应物的转化率;通过观察气泡,调节NH3与CO2通入比例;三颈烧瓶;
②生成的氨基甲酸铵小晶体悬浮在四氯化碳中,利用过滤得到的氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、不能加热烘干,应在真空40℃以下烘干,故答案为:c;
(3)尾气为氨气,可与稀硫酸反应,可用稀硫酸吸收,故答案为:稀硫酸;
(4)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00g,碳酸钙的物质的量为0.15mol,设样品中氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,依据碳元素守恒得到;
x+y=0.15
78x+79y=11.73
解得x=0.12mol
y=0.03mol
则样品中氨基甲酸铵的物质的量分数=$\frac{0.12mol×78g/mol}{11.73g}$×100%=80%,故答案为:80%.
点评 本题考查了物质制备实验的设计应用,为高考常见题型,侧重考查学生的分析能力,实验能力和计算能力,注意把握氨气的制备方法,氨基甲酸的制备实验装置分析判断,实验基本操作,混合物分离的实验设计,有关混合物的计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 放电时:电子移动方向由Pb通过导线向PbO2传递 | |
| B. | 充电时:阳极反应是PbSO42-+2e-+2H2O═PbO2+SO42-+4H+ | |
| C. | 放电时:正极反应是Pb-2e-+SO42-═PbSO4 | |
| D. | 充电时:铅蓄电池的阴极应与电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 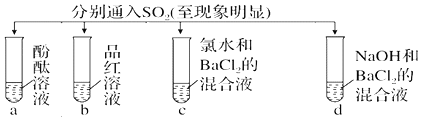 | ||||
| 现象 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 无色 | 无色 | 溶液变无色,白色沉淀 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,2.24L NH3与1.8g H2O,所含的质子数均为NA | |
| B. | 在常温常压下,1mol Cl2与足量的NaOH溶液完全反应,转移电子2NA | |
| C. | 在标准状况下,64g SO2 中含有的原子数为3NA | |
| D. | 在标准状况下,11.2L H2O含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1.12L CCl4含有的共价键数为0.2NA | |
| B. | 常温常压下,2.3g NO2和N2O4的混合物中含有的氧原子数为0.2NA | |
| C. | 过氧化钠与水反应时,生成0.lmol氧气转移的电子数为0.2NA | |
| D. | 常温下,0.1mol•L-1溶液中阴离子总数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、MnO4-、Ag+、Cl- | B. | Cu2+、NO3-、Na+、OH- | ||
| C. | Fe2+、NH4+、NO3-、SO42- | D. | Al3+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molBaCl2中含有的氯离子数为NA | |
| B. | 1mol镁原子中含有的电子数为2NA | |
| C. | 常温常压下,11.2LH2中含有的氢分子数为0.5NA | |
| D. | 16gO3中含有的氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,48gO3和48gO2含有的电子数目为3NA | |
| B. | 1molOH-离子中含电子数目为10 NA | |
| C. | 0.5L0.2mol•L-1的NaCl溶液中含有的Na+数是0.1 NA | |
| D. | 33.6LCO中含有的原子总数是3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com