
| A. | 滴加KI溶液时,转移2 mol e-时生成 1 mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,不是 SO2的漂白性 | |
| C. | 通入SO2时,SO2与I2反应,I2作氧化剂 | |
| D. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
分析 向CuSO4溶液中逐滴加KI溶液至过量,观察到产生白色沉淀CuI,发生2Cu2++4I-=2CuI↓+I2,再向反应后的混合物中不断通人S02气体,溶液逐渐变成无色,发生SO2+I2+2H2O=2HI+H2SO4,结合氧化还原反应来解答.
解答 解:A.滴加KI溶液时,反应为2Cu2++4I-=2CuI↓+I2,转移2mol e-时生成2mol白色沉淀,故A正确;
B.通入SO2后溶液逐渐变成无色,SO2+I2+2H2O=2HI+H2SO4,体现了SO2的还原性,故B错误;
C.通入S02时,S02与I2反应,SO2+I2+2H2O=2HI+H2SO4,I2作氧化剂,故C正确;
D.由反应2Cu2++4I-=2CuI↓+I2、SO2+I2+2H2O=2HI+H2SO4,根据氧化还原反应中氧化剂的氧化性大于氧化产物可知,氧化性为Cu2+>I2>SO2,故D正确;
故选B.
点评 本题考查物质的性质及氧化还原反应,为高频考点,把握发生的氧化还原反应为解答的关键,注意利用信息判断发生的反应及反应中元素的化合价变化,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | M | N | 除杂试剂 | 除杂方法 |
| A | C2H5OH | H2O | 生石灰 | 蒸馏 |
| B | CH4 | CH2═CH2 | 酸性KMnO4溶液 | 洗气 |
| C | CH3COOCH2CH3 | CH3COOH、C2H5OH | NaOH溶液 | 分液 |
| D | 苯酚 | 三溴苯酚 | 水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
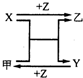 回答下列问题:
回答下列问题: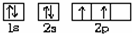 ,乙的电子式为
,乙的电子式为 .
.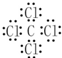 ,乙的化学式为NaCl.
,乙的化学式为NaCl.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | ①能使溴的四氯化碳溶液褪色; ②填充模型为 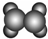 ; ;③能与水在一定条件下反应生成C. |
| B | ①由C、H两种元素组成; ②球棍模型为 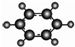 . . |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成一种有香味的油状物. |
| D | ①由C、H、O三种元素组成; ②球棍模型为 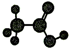 . . |
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$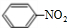 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
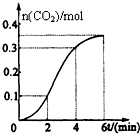 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A. | 反应2~4分钟内平均反应速率最大 | |
| B. | 反应4分钟后平均反应速率最小 | |
| C. | 反应开始4分钟内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2分钟初至第3分钟末生成CO2的平均反应速率为0.1mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbO2是电池的负极 | |
| B. | 负极的电极反应式为:Pb+SO42--2e-═PbSO4 | |
| C. | 铅蓄电池放电时,每转移2mol电子时消耗1mol硫酸 | |
| D. | 电池放电时,两极质量均增加,且每转移1mol电子时正极质量增加48g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
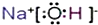 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
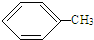 +3HO-NO2$\stackrel{浓硫酸}{→}$
+3HO-NO2$\stackrel{浓硫酸}{→}$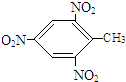 +3H2O.
+3H2O. .
.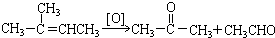
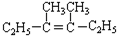 在上述类似条件下发生反应,请写出反应的方程式
在上述类似条件下发生反应,请写出反应的方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤干馏可以提高能源的利用率 | |
| B. | 甲烷也是一种温室气体,应禁止使用天然气 | |
| C. | 锌-锰干电池是对环境没任何污染的理想电池 | |
| D. | 寻找高效催化剂,使二氧化硅分解产生硅的同时释放能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com