
分析 (1)CO+H2O(g)?CO2 +H2,
初始浓度(mol/L):0.2 0.3 0 0
变化浓度(mol/L):0.12 0.12 0.12 0.12
平衡浓度(mol/L):0.08 0.28 0.12 0.12
根据K=$\frac{c({H}_{2})•c(C{O}_{2})}{c(CO)•c({H}_{2}O)}$计算化学平衡常数;
(2)①CH4(g)+4NO2(g)→4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)→2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
根据盖斯定律(①+②)×$\frac{1}{2}$来书写热化学方程式;
(3)燃料电池中,燃料做负极,发生氧化反应.
解答 解:(1)利用三段式计算,
CO+H2O(g)?CO2 +H2,
初始浓度(mol/L):0.2 0.3 0 0
变化浓度(mol/L):0.12 0.12 0.12 0.12
平衡浓度(mol/L):0.08 0.28 0.12 0.12
化学平衡常数K=$\frac{c({H}_{2})•c(C{O}_{2})}{c(CO)•c({H}_{2}O)}$=$\frac{0.12×0.12}{0.08×0.28}$=1,
故答案为:1;
(2)①CH4(g)+4NO2(g)→4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)→2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
根据盖斯定律(①+②)×$\frac{1}{2}$,得:CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol,
故答案为:CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol;
(3)在燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
故答案为:2NH3-6e-+6OH-=N2+6H2O.
点评 本题主要考查较为综合,为高考常见题型,侧重于学生的分析能力和计算能力的考查,题目涉及化学平衡常数的计算、盖斯定律的应用、原电池电极反应的书写等知识,中等难度,答题时注意化学原理知识的灵活运用.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙酸是有机合成的中间产物,下面是它的一种实验室合成路线:
苯乙酸是有机合成的中间产物,下面是它的一种实验室合成路线: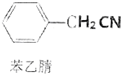 +H2O+H2SO4$\stackrel{100~130℃}{→}$
+H2O+H2SO4$\stackrel{100~130℃}{→}$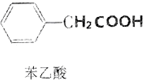 +NH4HSO4
+NH4HSO4查看答案和解析>>
科目:高中化学 来源: 题型:实验题
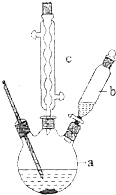
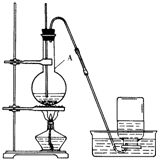
 图为实验室制溴苯的实验装置图,请根据图回答下列问题
图为实验室制溴苯的实验装置图,请根据图回答下列问题 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 “低碳经济”已成为科学家研究的主要课题之一.
“低碳经济”已成为科学家研究的主要课题之一.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
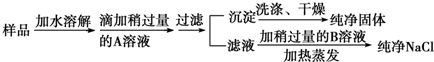
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ②③⑥⑦ | C. | ②⑤⑥⑦ | D. | ①③⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com