
| A. | SO2、H2S、Cl2 | B. | SO2、O2、NH3 | C. | HCl、HBr、HI | D. | SO2、CO2、O2 |
分析 气体之间不发生化学反应就能共存;浓硫酸是酸能和碱性气体发生反应,浓硫酸有强氧化性能与强还原性的气体反应,所以浓硫酸能干燥酸性气体或中性气体.
解答 解:A.SO2、H2S、Cl2三种气体之间,两两之间能发生反应,且H2S能被浓硫酸氧化,不能用浓硫酸干燥,故A错误;
B.SO2、NH3、O2三种气体之间不发生反应,但氨气是碱性气体,能和浓硫酸反应,所以氨气不能用浓硫酸干燥,故B错误;
C.HCl、HBr、HI三种气体,三种气体之间不发生反应,但是HI有较强还原性能和浓硫酸反应,所以HI不能用浓硫酸干燥,故C错误;
D.SO2、CO2、O2三种气体之间不发生反应,且这三种气体和浓硫酸不反应,所以能共存且能用浓硫酸干燥,故D正确.
故选D.
点评 本题考查了气体的共存与干燥,难度不大,注意浓硫酸不能干燥碱性气体和强还原性的气体.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:解答题
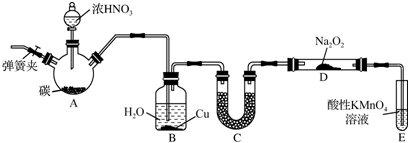
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:
铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂 | B. | 还原剂 | C. | 催化剂 | D. | 吸附剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3已部分氧化 | |
| B. | 加入硝酸钡溶液生成的沉淀一定含BaSO4 | |
| C. | 加入硝酸后的沉淀一定含BaSO3 | |
| D. | 此实验不能确定Na2SO3是否部分氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

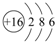 .
. .
.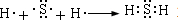 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的体积分数增大 | B. | 平衡向右移动 | C. | B的转化率提高 | D. | a+b<c+d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com