


科目:高中化学 来源: 题型:
| A、等pH等体积的盐酸和醋酸加水稀释10倍后,前者的pH大于后者 |
| B、等pH等体积的盐酸和醋酸分别中和0.1mol/L的NaOH溶液,消耗NaOH溶液体积相等 |
| C、等浓度等体积的盐酸和醋酸与足量的锌粉反应,开始时前者产生H2的速率大于后者,最终产生的H2相等 |
| D、等浓度等体积的盐酸和醋酸分别中和0.1mol/L的NaOH溶液,消耗NaOH溶液体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 | 简 答 |
| 取样,加入过量的稀硝酸 | 加硝酸的目的是: | |
| 加入硝酸银溶液 | 反应的化学方程式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解).试计算:
将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解).试计算:查看答案和解析>>
科目:高中化学 来源: 题型:
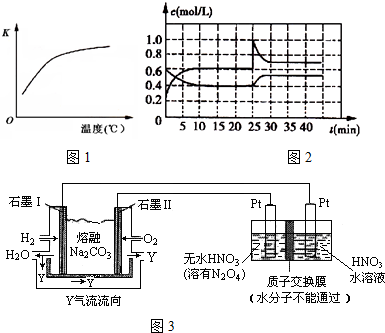
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,稀释0.1mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降 |
| B、常温下,c(NH4+)相等的①(NH4)2SO4 ②(NH4)2Fe(SO4)2 ③NH4Cl④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ |
| C、pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)<c(NaHCO3)<c(Na2CO3) |
| D、某温度时水的离子积常数KW=10-13若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液PH=2,则a:b=2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解时,石墨作阴极,不锈钢作阳极 |
| B、电解时,阳极反应是:I--6e-+3H2O=IO3-+6H+ |
| C、溶液调节至强酸性,对生产有利 |
| D、电解后溶液的pH比电解前大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com