


| 实验操作 | 主要现象 | 结论或解释 |
| 步骤1:取少量固体于试管中,加入足量 ①氯化铁溶液. | 固体减少且剩余, 淡黄色溶液变浅. | 固体中含有金属铁 |
| 步骤2:分离步骤1的剩余固体于另一试管中,加入足量 ②盐酸,将反应后溶液分成甲、乙两份. | 固体全部消失. | 反应的化学方程式 ③ Fe3O4+8HCl=FeCl2+2FeCl3+H2O. |
| 步骤3:在步骤2的甲溶液中加入几滴 ④高锰酸钾溶液. | 紫红色褪去. | 溶液中含有Fe2+. |
| 步骤4:在步骤2的乙溶液中加入几滴⑤KSCN溶液. | 溶液变成红色. | 溶液中含有Fe3+. |
分析 (1)依据硬质试管中中铁与水蒸气反应会生成四氧化三铁和氢气分析判断;
(2)氢气具有可燃性,燃烧的产物是水,据此确定氢气的检验方法;
(3)氢气是一种难溶于水的物质,可以根据排水量气法获得产生的氢气的体积,注意导管是短进长出;
(4)金属铁可以和氯化铁溶液之间反应,铁的氧化物可以和稀盐酸之间反应生成含铁离子的盐,亚铁离子能使高锰酸钾褪色,铁离子遇到硫氰化钾溶液显示红色,据此可以检验各种价态的铁离子的存在.
解答 解:(1)铁与水蒸气反应会生成四氧化三铁和氢气,反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)氢气具有可燃性,燃烧的产物是水,氢气的检验方法:将所得的气体在导管出口处点燃,导管上方罩一个干燥的烧杯,若产生淡蓝色的火焰同时烧杯内壁出现水珠,证明产生的气体是氢气,故答案为:将所得的气体在导管出口处点燃,导管上方罩一个干燥的烧杯,若产生淡蓝色的火焰同时烧杯内壁出现水珠,证明产生的气体是氢气;
(3)如果要测量实验中产生的气体体积,可以根据排水量气法获得产生的氢气的体积,采用下列实验装置: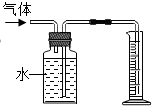 ,
,
故答案为: ;
;
(4)步骤1、金属铁可以和氯化铁之间反应得到氯化亚铁,但是铁的氧化物都不能和氯化铁之间反应,所以取少量固体于试管中,加入足量氯化铁溶液,会看到固体减少且剩余,淡黄色溶液变浅,证明含有金属铁;
步骤2、步骤1的剩余固体于另一试管中,加入足量的盐酸溶液,则含铁的化合物会和盐酸之间反应,生成氯化亚铁和氯化铁的混合物,发生的反应为:Fe3O4+8HCl=FeCl2+2FeCl3+H2O,
步骤3、将步骤2反应后溶液分成甲、乙两份,其中含有氯化亚铁和氯化铁,溶液中加入几滴高锰酸钾,亚铁离子会和其反应,导致高锰酸钾褪色,可以证明亚铁离子的存在;
步骤4、在步骤2的乙溶液中加入几滴硫氰化钾溶液,溶液变成红色,证明铁离子的存在,
故答案为:氯化铁溶液;盐酸溶液;Fe3O4+8HCl=FeCl2+2FeCl3+H2O;高锰酸钾溶液;KSCN溶液.
点评 本题考查学生含铁的化合物的性质以及铁离子、亚铁离子的检验知识,注意知识的归纳和梳理是解题的关键,难度中等.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
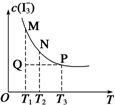 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq).该平衡体系中,I3-的物质的量浓度与温度(T)的关系如图所示(曲 线上的任何一点都代表平衡状态).下列说法正确的是( )| A. | 反应速率:vM>vP | B. | 平衡常数:KN<KP | ||
| C. | M、N两点相比,M点的c(I-)大 | D. | Q点时,v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,甲失电子比乙失电子多 | |
| B. | 甲在化合物中的化合价比乙在化合物中的高 | |
| C. | 甲能与稀盐酸反应生成氢气,而乙不能 | |
| D. | 甲与乙组成原电池时,甲为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑤ | C. | ③④⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KI溶液中:Ca2+、Na+、ClO-、Cl- | |
| B. | 滴入酚酞试液显红色的溶液中:Al3+、K+、AlO2-、SO42- | |
| C. | c(H+)=10-12mol•L-1的溶液中:K+、Na+、NO3-、Cl- | |
| D. | 加入铝粉产生氢气的溶液中:Na+、Mg2+、HCO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com