
| A. | 水果存贮库常放置浸泡高锰酸钾溶液的硅藻土,可以延长水果保存期 | |
| B. | 甲醛可使蛋白质发生变性,所以福尔马林可用于杀菌消毒 | |
| C. | 用加入足量氢氧化钠溶液共热的方法可以区分地沟油与矿物油 | |
| D. | 切开的苹果空气中变黄与漂白过的纸张久置变黄原理相似 |
分析 A.乙烯较活泼,能被强氧化剂高锰酸钾氧化;
B.甲醛能使细菌或病毒中的蛋白质发生凝聚而变性;
C.油脂在碱性条件下,矿物油成分是烃类,不水解;
D.纸张久置变黄因为纸张纤维间的空隙中会渗入很多霉菌之类的真菌孢子,苹果久置变黄是因为所含二价铁离子被氧化生成三价铁离子.
解答 解:A.乙烯具有催熟作用,为了延长水果的保鲜期,用高锰酸钾可以除掉乙烯,故A正确;
B.甲醛能使细菌或病毒中的蛋白质发生凝聚而变性,从而使细菌或病毒中蛋白质失去生物活性,所以甲醛溶液可用于杀菌消毒,故B正确;
C.地沟油的成分是油脂,油脂在碱性条件下,矿物油成分是烃类,不水解,所以用加入足量氢氧化钠溶液共热的方法可以区分地沟油与矿物油,故C正确;
D.纸张久置变黄因为纸张纤维间的空隙中会渗入很多霉菌之类的真菌孢子,苹果久置变黄是因为所含二价铁离子被氧化生成三价铁离子,二者原理不相同,故D错误.
故选D.
点评 本题考查了元素化合物的性质及用途,题目难度不大,考查了化学知识在生产生活中的应用,注意把握常见物质的性质和用途.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 在酸性土地中 | |
| B. | 在潮湿疏松的土壤中 | |
| C. | 在干燥致密不透气的土壤中 | |
| D. | 在含碳粒较多,潮湿透气的中性土壤中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 NH4NO3溶液中:c(NH4+)>c(NO3-)>c(H+)>c(OH-) | |
| B. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 向10 mL 0.2 mol•L-1 NaCl溶液中滴入2 mL 0.1 mol•L-1 AgNO3溶液,溶液中离子浓度大小关系:c(Na+)>c(NO3-)=c(Cl-)>c(Ag+) | |
| D. | 常温下pH=2的醋酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中国的圆珠笔头一直需要进口笔尖钢,经过5年数不清的失败,2016年9月,中国太钢集团利用家常和面原理在钢水中加入添加剂试验成功,造出圆珠笔头,可完全替代进口.由此信息可知笔尖钢为合金,且具有良好的切削性 | |
| B. | 日前从中国建筑材料科学研究总院获悉,天宫二号采用了该院研发改进的新材料,耐辐射石英玻璃,其主要成分为硅 | |
| C. | 用废轮胎、废电缆打碎制成的塑胶跑道,可以提高原子利用率 | |
| D. | 塑化剂DEHP邻苯二甲酸二(2-乙基)己脂,对人体无害,可用作食品添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加酶洗衣粉洗衣服时水的温度越高越好 | |
| B. | 用CO2合成聚碳酸酯可降解塑料能实现“碳”的循环 | |
| C. | 用纳米铁粉的吸附性去除污水中的Cu2+、Hg2+等重金属离子 | |
| D. | 用高锰酸钾溶液、酒精、双氧水的强氧化性进行杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
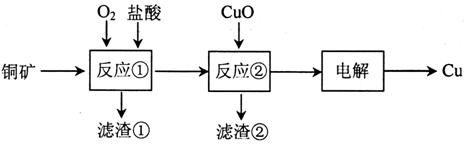
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
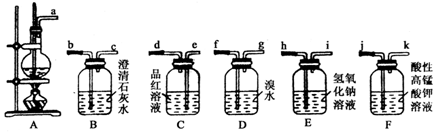
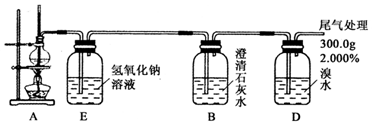
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化合物中呈+2价 | B. | 氢氧化物呈两性 | ||
| C. | 单质使水分解,放出氢气 | D. | 碳酸盐难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com