
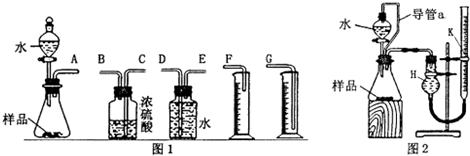
分析 (1)①氧化钠和水反应生成氢氧化钠,过氧化钠和水反应生成氢氧化钠和氧气;
②装置的组装顺序:合金与酸反应→用排水量气法测定氢气的体积;
②根据镁、铝与稀硫酸反应放热且生成气体使锥形瓶中气体压强变大分析;
③必须满足量筒中的液面与广口瓶的液面相平,读数时一定要平视读数;
(2)①导管a能够使锥形瓶和分液漏斗中的压强相等,据此分析对稀硫酸顺利等下的影响及对测定氢气体积的影响;
②在测量氢气体积时,为了使测量更为准确,要注意上下移动水准管,使左右两管的液面相平,以使量气管中的气压与大气气压相等,读数时视线应与左管内凹液面最低处相平,以减少观察误差;
③若实验中样品的质量为wg,实验前后量气管k中液面读数分别为V1、V2(换算成标况),过氧化钠和水反应生成的氧气物质的量=$\frac{{V}_{1}-{V}_{2}}{22.4}$mol,结合过氧化钠和水反应生成氧气的定量关系,计算得到过氧化钠质量得到过氧化钠含量.
解答 解:(1)①氧化钠和水反应生成氢氧化钠,过氧化钠和水反应生成氢氧化钠和氧气,反应的化学方程式为:Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑,
故答案为:Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑;
②装置的组装顺序:合金酸水反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:(A)接(E)(D)接(G);
故答案为:E;D;G;
(2)①装置中导管a的作用是:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差,
故答案为:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差;
②读数时,要注意视线应于量气管凹液面的最低处保持水平;每次读数前应上下移动水准管,待两管液面相平再读数是为了防止水的压强造成的误差,实验结束后,在读取量气管k中液面读数时,最合理的顺序是BCA,
故答案为:BCA;
③若实验中样品的质量为wg,实验前后量气管k中液面读数分别为V1、V2(换算成标况),过氧化钠和水反应生成的氧气物质的量=$\frac{{V}_{1}-{V}_{2}}{22.4}$mol,结合过氧化钠和水反应生成氧气的定量关系,2Na2O2~O2,计算得到过氧化钠质量得到过氧化钠含量;Na2O2%=$\frac{\frac{{V}_{1}-{V}_{2}}{224}mol×78g/mol×2}{wg}$×100%=195×$\frac{{V}_{1}-{V}_{2}}{28w}$×100%,
故答案为:195×$\frac{{V}_{1}-{V}_{2}}{28w}$×100%.
点评 本题主要考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,题目难度中等,理解实验原理是解题的关键,本题是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 棉花、蚕丝和锦纶的主要成分是纤维素 | |
| B. | 油脂在空气中完全燃烧生成二氧化碳和水 | |
| C. | 苯、乙醇和乙酸都能发生取代反应 | |
| D. | 淀粉和纤维素的组成通式为(C6H10O5)n,二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,判断下列物质不能与B发生化学反应的有C
,判断下列物质不能与B发生化学反应的有C
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵和过氧化氢的分解 | B. | 二氧化硅与二氧化碳的熔化 | ||
| C. | 蔗糖和干冰的熔化 | D. | 氯化镁和氯化铝的熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com