
| A、含有弱酸根盐的水溶液一定显碱性 |
| B、室温下,pH相同、体积相同的氨水和氢氧化钠两种溶液分别加水稀释2倍后,两溶液的pH均减小,其中,稀释后的氢氧化钠的pH比氨水的小 |
| C、室温时,0.01 mol?L-1醋酸溶液的pH=2 |
| D、室温时,0.01 mol?L-1醋酸溶液中加入等体积等浓度的NaOH溶液后,所得溶液的pH=7 |


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
| A、PbO2具有氧化性 |
| B、白色不溶物为PbSO3 |
| C、白色不溶物为PbSO4 |
| D、白色不溶物既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
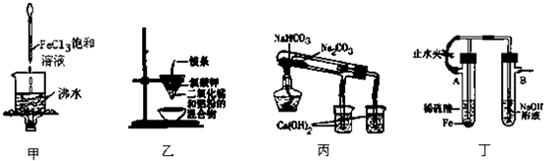
| A、用甲装置可制得Fe(OH)3胶体 |
| B、用乙装置可制得金属锰 |
| C、用丙装置验证NaHCO3和Na2CO3的热稳定性 |
| D、用丁装置能较长时间观察到Fe(OH)2白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将二氧化硫通入品红溶液中,溶液显红色,加热后变为无色 |
| B、向溶液中加入新制氯水,再滴加KSCN溶液,若溶液变红色,则证明溶液中一定含有Fe2+ |
| C、将干燥的红纸条放进盛有氯气的集气瓶中,红纸条褪色 |
| D、在稀硫酸中加入铜粉,铜粉不溶解;再加入KNO3固体,铜粉就会溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.6mol/L |
| B、0.06mol/(L?s) |
| C、0.03mol/L |
| D、0.03mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2d mol/L |
| B、4d mol/L |
| C、5d mol/L |
| D、2.5d mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1NaAlO2溶液:H+、Na+、Cl-、SO42- |
| B、0.1 mol?L-1的Na HCO3溶液:K+、Ba2+、NO3-、OH- |
| C、0.1 mol?L-1硫酸铝的溶液中:NO3-、I-、Na+、AlO2- |
| D、0.1 mol?L-1碳酸钾的溶液中:NH4+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用CCl4萃取碘水中的碘,上层的水从分液漏斗的下端放出 |
| B、配制溶液时,摇匀后发现液面低于刻度,再加水至刻度线 |
| C、把溶液从烧杯中转移到容量瓶时用玻璃棒引流 |
| D、称量时,托盘天平的左盘放砝码,右盘放称量药品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com