
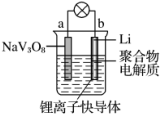
 水系锂电池具有安全、环保和价格低廉等优点,成为当前电池研究领域的热点. 以钒酸钠(NaV3O8)为正极材料的电极反应式为NaV3O8+xLi++xe-═NaLixV3O8,则下列说法不正确的是( )
水系锂电池具有安全、环保和价格低廉等优点,成为当前电池研究领域的热点. 以钒酸钠(NaV3O8)为正极材料的电极反应式为NaV3O8+xLi++xe-═NaLixV3O8,则下列说法不正确的是( )| A. | 放电时,负极的电极反应式:Li-e-═Li+ | |
| B. | 该电池可以用硫酸钠溶液作电解质 | |
| C. | 充电过程中阳极的电极反应式:NaLixV3O8-xe-═NaV3O8+xLi+,NaLixV3O8中钒的化合价发生变化 | |
| D. | 充电过程中Li+从阳极向阴极迁移 |
分析 放电时,b电极Li作负极,电极反应式为Li-e-═Li+,a作正极,电极反应式为NaV3O8+xLi++xe-=NaLixV3O8,则电池反应式为NaV3O8+xLi=NaLixV3O8,充电时,阴极、阳极电极反应式与负极、正极反应式正好相反,充电时,阳离子向阴极移动、阴离子向阳极移动,据此分析解答.
解答 解:A.放电时,b电极Li作负极,Li失电子发生氧化反应,电极反应式为Li-e-═Li+,故A正确;
B.溶液中阳离子必须有锂离子从而参与正极反应,故B错误;
C.充电时,阴极、阳极电极反应式与负极、正极反应式正好相反,所以阳极的电极反应式为NaLixV3O8-xe-=NaV3O8+xLi+,NaLixV3O8中Na、O、Li元素化合价不变,则钒的化合价发生变化,故C正确;
D.充电时,阳离子向阴极移动、阴离子向阳极移动,所以Li+从阳极向阴极迁移,故D正确;
故选B.
点评 本题考查化学电源新型电池,为高考高频点,明确原电池和电解池原理是解本题关键,难点是电极反应式的书写,知道物质的性质,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 所有卤代烃都是无色、难溶于水,比水重的液体 | |
| B. | 所有卤代烃在适当条件下都能发生取代反应 | |
| C. | 所有卤代烃在适当条件下都能发生消去反应 | |
| D. | 氟氯代烷(即氟利昂)是优良的制冷剂、灭火剂,需推广使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 3:2 | C. | 2:3 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制备较弱酸 | 硫化氢通入硫酸铜溶液中不反应 |
| B | 压强越大,反应速率越快 | 加压,该反应2NH3?N2+3H2的正反应速率加快 |
| C | 金属性较强的金属为原电池的负极 | 铁、铜和浓硝酸形成的原电池,铁为负极 |
| D | 主族元素的最高正化合价等于主族的序数 | 氧的最高正化合价是+6 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备1mol HRO3转移电子数一定为2NA | |
| B. | R、Z简单离子的还原性:Z(离子)<R(离子) | |
| C. | HZ分子的稳定性大于HR分子 | |
| D. | HRO3与HZ计量数之比为1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)相等的NH4Cl溶液中的c(Cl-)大于(NH4)2Fe(SO4)2溶液中c(SO42-) | |
| B. | 常温下,pH=1的醋酸与pH=13的NaOH 溶液混合后的溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1mol•L-1的Na2CO3和NaHCO3混合溶液中 2c(Na+)═3c(CO32-)+3c(HCO3-) | |
| D. | 稀释氯化铵溶液过程中,NH4+的水解程度和水的电离程度都增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | H2有还原性,浓硫酸有强氧化性 | 不能用浓硫酸干燥H2 |
| B | CuS难溶于水和硫酸 | 反应:H2S+CuSO4=CuS↓+H2SO4 可以发生 |
| C | 海水中含有大量的Cl-、Br-等离子 | 向海水中通入F2可大量获得Cl2、Br2 |
| D | SO2具有酸性和漂白性 | 往紫色石蕊溶液中通入SO2,溶液先变红再褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷在足量氧气中燃烧生成一种氧化物,则碳在足量氧气中燃烧也生成一种氧化物 | |
| B. | 稀硝酸能将木炭氧化成二氧化碳,同理稀硫酸也能将木炭氧化成二氧化碳 | |
| C. | CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似 | |
| D. | NaHCO3、(NH4)2CO3固体受热后均能生成气体,则Na2CO3固体受热后也能生成气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com