


 含有相同的官能团,但是碳架结构不同,属于碳链异构;
含有相同的官能团,但是碳架结构不同,属于碳链异构;

科目:高中化学 来源: 题型:
 0mol.L-1NaHSO3(含少量淀粉)10.0mL和0.020mol.L-1KIO3(过量)酸性溶液40.0mL混合(混合后体积变化忽略不计),在如下不同温度下分别进行实验,记录从反应开始到溶液变蓝所需时间,实验数据如下表:
0mol.L-1NaHSO3(含少量淀粉)10.0mL和0.020mol.L-1KIO3(过量)酸性溶液40.0mL混合(混合后体积变化忽略不计),在如下不同温度下分别进行实验,记录从反应开始到溶液变蓝所需时间,实验数据如下表:| 实验序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 温度/℃ | 10 | 20 | 25 | 30 | 35 | 40 | 50 | 55 | 60 |
| 溶液变蓝时间/s | 80 | 72 | 65 | 57 | 61 | 72 | 78 | 始终不变蓝 | 始终不变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除②⑤③外 | B、④⑤⑥ |
| C、①②③⑥ | D、除⑥外 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
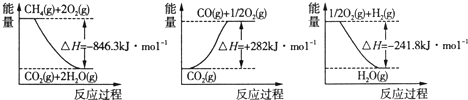
| ||
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 | |
| ① | Cl2 | FeBr3 | Cl- | ||
| ② | KClO3 | 浓盐酸 | Cl2 | ||
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A、第③组反应的离子方程式为:2MnO4-+3H2O2+6H+→2Mn2++4O2↑+6H2O |
| B、第②组事实可以推测:ClO-、Cl-不能在溶液中大量共存 |
| C、氧化性强弱的比较:KClO3<Cl2 |
| D、第①组的反应只可能有一种元素被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有CO32-或HCO3- |
| B | 向某溶液中先滴加盐酸无现象,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42- |
| C | 分别测定同温 同浓度NaCl与CH3COONa溶液的pH | CH3COONa溶液的pH小 | 盐酸的酸性强于醋酸的酸性 |
| D | 向无水乙醇中加入浓H2SO4,加热至170℃将产生的气体通入酸性KMnO4 溶液 | 紫红色褪去 | 使溶液褪色的不一定是乙烯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com