
| A. | 1mol•L-1AlCl3 溶液中,含 Al3+数目小于 NA | |
| B. | 标准状况下,6.0gNO 和 2.24LO2混合,所得气体的分子数目为 0.2NA | |
| C. | 25℃,1LpH=1 的稀硫酸中含有的 H+数为 0.2NA | |
| D. | 由 1molCH3COONa 和少量 CH3COOH 形成的中性溶液中,CH3COO-数目为NA 个 |
分析 A.溶液体积未知;
B.标准状况下,6.0gNO和2.24LO2混合后生成的NO2中存在平衡:2NO2?N2O4;
C.25℃,pH=1 的稀硫酸中氢离子物质的量浓度为0.1mol/L;
D.由1molCH3COONa和少量CH3COOH形成的中性溶液中,根据电荷守恒来分析.
解答 解:A.溶液体积未知,无法确定铝离子数目,故A错误;
B.标准状况下,6.0gNO和2.24LO2混合后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减小,故B错误;
C.25℃,pH=1 的稀硫酸中氢离子物质的量浓度为0.1mol/L,1L溶液中含有氢离子数目为:0.1mol/L×1L×NA=0.1NA,故C错误;
D.由1molCH3COONa和少量CH3COOH形成的中性溶液中,根据电荷守恒可知:n(CH3COO-)+n(OH-)=n(H+)+n(Na+),由于溶液显中性,故有n(OH-)=n(H+),则有:n(CH3COO-)=n(Na+)=1mol,则醋酸根的个数为NA个,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,注意盐类水解的性质及溶液中电荷守恒规律的应用,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氨气溶于水能导电,故氨气属于电解质 | |
| B. | 碳酸钡难溶于水,故碳酸钡属于弱电解质 | |
| C. | 硫酸是强电解质,故纯硫酸能导电 | |
| D. | 室温下,氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 非金属性:甲<丙 | B. | 原子半径:乙<丁 | ||
| C. | 最外层电子数:乙<丙 | D. | 戊一定是硫元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
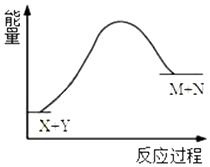
| A. | X的能量低于M的能量 | |
| B. | Y的能量低于N的能量 | |
| C. | X和Y总能量低于M和N总能量 | |
| D. | 该反应是吸热反应,反应条件是加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 青蒿素分子式为C15H2405 | |
| B. | 反应②原子利用率为100% | |
| C. | 该过程中青蒿素生成双氢青蒿素属于氧化反应 | |
| D. | 1 mol青蒿琥酯与氢氧化钠溶液反应,最多消耗1 mol氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
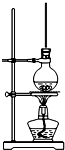 将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:
将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:| 时间(min) | 20 | 40 | 60 | 80 | 100 | 120 |
| 酯的厚度(mm) | 4 | 6 | 7 | 7.5 | 8 | 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验及现象 | 结论 |
| A | 向AgNO3和AgCl的浊液中滴入0.1mol/LNa2S溶液,生成黑色沉淀 | Ag2S的溶度积比AgCl的小 |
| B | 将光亮镁条放入盛有NH4Cl溶液的试管中,产生大量气泡,同时将湿润的红色石蕊试纸靠近试管口,试纸变蓝 | 反应产生的气体一定是NH3 |
| C | 向溶液X中先滴加稀硝酸,在滴加Ba(NO3)2溶液,出现白色沉淀 | 溶液X中一定含有SO42- |
| D | 将铜粉加入1.0mol/L Fe2(SO4)3溶液中,溶液变蓝 | 说明氧化性Fe3+>Cu2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com