
分析 根据有机物的质量和相对分子质量可计算有机物的物质的量,根据生成的水和二氧化碳的质量可计算有机物中含有的C、H原子个数,结合相对分子质量可计算O原子个数,进而可求得分子式,结合其核磁共振氢谱中吸收峰的个数和面积之比确定其结构简式.
解答 解::(1)设有机物的分子式为CXHYOz,
n(CXHYOz)=$\frac{1.8g}{90g/mol}$=0.02mol,
n(H2O)=$\frac{1.08g}{18g/mol}$=0.06mol,
n(CO2)=$\frac{2.64g}{44g/mol}$=0.06mol,
所以x=3,y=6.
所以反应物分子式为C3H6Oz,
又因为有机物分子量为90,则有机物中O原子数为$\frac{90-12×3-1×6}{16}$=3,
故推得有机物分子式为C3H6O3,
答:该有机化合物分子式为C3H6O3;
(2)若该有机物呈现酸性,说明含有羧基,且该有机物的核磁共振氢谱图中出现4个吸收峰,说明含有4类氢原子,面积比为3:1:1:1,则这四类氢原子个数之比为3:1:1:1,所以其结构简式为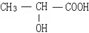 ,
,
答:该有机物分子的结构简式为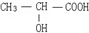 .
.
点评 本题考查有机物分子式的确定,为高频考点,侧重于学生分析能力和计算能力的考查,题目难度不大,注意根据相对分子质量确定氧原子个数.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其氢氧化物中碱性最强的是NaOH | B. | 单质还原能力最强的是钠 | ||
| C. | 单质的与水反应时钠最剧烈 | D. | 原子半径逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
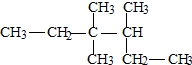
| A. | 3,4,4-三甲基己烷 | B. | 3,3-二甲基-2-乙基戊烷 | ||
| C. | 3,3,4-三甲基己烷 | D. | 3,3-二甲基-4-乙基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
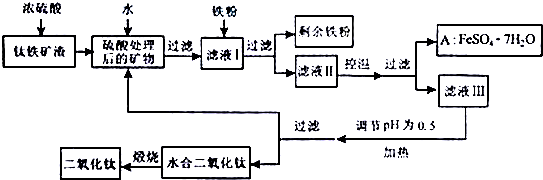
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
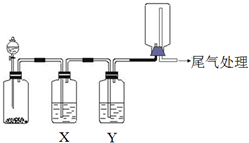 利用如图装置可以进行实验并能达到实验目的是( )
利用如图装置可以进行实验并能达到实验目的是( )| 选项 | 实验目的 | X中试剂 | Y中试剂 |
| A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
| C | 验证电石与饱和食盐水反应生成的气体的性质并收集 | CuSO4溶液 | KMnO4 溶液 |
| D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com