
在xR2+ +yH+ +O2=mR3+ +nH2O的离子方程式中,对m和R3+判断正确的是
A.m=4,R3+是氧化产物
B.m=2y,R3+是氧化产物
C.m=2,R3+是还原产物
D.m=y,R3+是还原产物
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源:2014秋贵州省遵义市高二上学期期中化学(文)试卷(解析版) 题型:选择题
下列关于食物酸碱性的说法错误的是
A.食物的酸碱性是按食物在体内代谢最终产物的性质来分类的
B.酸性食物在体内代谢后可形成阴离子酸根
C.碱性食物在体内代谢后可形成含金属阳离子的碱性物质
D.某些水果酸味很强,它们是酸性食物
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高二上学期期中联考化学试卷(解析版) 题型:选择题
下列有关沉淀溶解平衡的说法正确的是
A.Ksp (AB2)小于Ksp (CD),则AB2的溶解度小于CD的溶解度
B.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,AgCl的Ksp增大
C.在AgI的沉淀溶解平衡体系中,加入K2S固体,AgI沉淀可转化为Ag2S沉淀
D.在CaCO3的沉淀溶解平衡体系中,通入CO2气体,溶解平衡不移动
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:填空题
(6分)(1)已知0.1mol/L的NaHSO4溶液中H+ 的物质的量浓度为0.1mol/L,请回答下列问题:
①写出NaHSO4在水溶液中电离的方程式:___________________________________。
②若将NaHSO4与Ba(OH)2在溶液中按物质的量比为2:1混合,反应的离子方程式是:___________________________________________________________。
若将NaHSO4与Ba(OH)2在溶液中按物质的量比为1:1混合,反应的离子方程式是:___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:选择题
下列关于物质的量浓度的表述中正确的是
A.0.3 mol/L Na2SO4溶液中含有Na+ 和SO42-总物质的量为0.9mol
B.当1L水吸收22.4LNH3时所得氨水的浓度不是1 mol/L,只有当22.4L NH3溶于水制得1L氨水时,其浓度才是1 mol/L
C.10℃时0.5 mol/L的稀盐酸100mL,蒸发掉5g水,冷却到10℃时,其体积小于100mL,它的物质的量浓度大于0.5 mol/L
D.10℃时0.5 mol/L的KCl饱和溶液100mL,蒸发掉5g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.5 mol/L
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:选择题
下列有关说法不正确的是
A.化学实验中不能把鼻孔凑到容器口去闻药品的气味,不得尝任何药品的味道。
B.过滤实验中若发现滤液浑浊,采取的措施是重新过滤。
C.用CCl4萃取碘水中的碘后,若再从CCl4中提取碘,应采用的方法是蒸馏而不是蒸发。
D.若夜晚发现家中天然气泄漏,不能开灯,应立即打开抽油烟机。
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高二上学期期中考试化学试卷(解析版) 题型:填空题
(8分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程式为: 。
(2)今有如下两个热化学方程式:?则a b(填“>”、“=”或“<”)
H2(g)+ 1/2O2(g)=H2O(g) ΔH1=a kJ·mol-1?
H2(g)+ 1/2O2(g)=H2O(l) ΔH2=b kJ·mol-1?
(3)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2(g)+3H2(g)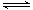 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH= ;
CH3OCH3(g) + CO2 (g)的ΔH= ;
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高二上学期期中考试化学试卷(解析版) 题型:选择题
下列变化中不属于放热反应的是
A.葡萄糖在人体内缓慢氧化
B.煤的燃烧
C.过氧化钠与水的反应
D.灼热的炭和二氧化碳气体化合
查看答案和解析>>
科目:高中化学 来源:2014秋河北省、临漳一中、永年二中高二上学期期中联考化学试卷(解析版) 题型:选择题
下列金属防腐的措施中,使用外加电流的阴极保护法的是
A.水中的钢闸门连接电源的负极
B.金属护栏表面涂漆
C.汽车底盘喷涂高分子膜
D.地下钢管连接镁块
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com