
据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH 2K2CO3+6H2O请填空:
2K2CO3+6H2O请填空:
(1)充电时:①原电池的负极与电源负极相连.②阳极的电极反应式为 .
(2)放电时:负极的电极反应式为 .
(3)在此过程中若完全反应,乙池中A极的质量升高648g,则甲池中理论上消耗O2 L(标准状况下).
(4)若在常温常压下,1gCH3OH燃烧生成CO2和液态H2O时放热22.68kJ,表示该反应的热化学方程式为 .
考点: 化学电源新型电池.
专题: 电化学专题.
分析: (1)放电时,负极上甲醇失电子发生氧化反应;
(2)充电时,原电池负极与电源负极相连,阳极上失电子发生氧化反应;
(3)乙池中B极上银离子得电子发生还原反应,根据转移电子相等计算氧气的体积;
(4)n(CH3OH)= mol,结合方程式2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)计算反应热.
mol,结合方程式2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)计算反应热.
解答: 解:(1)充电时,原电池负极与电源负极相连,阳极上氢氧根离子失电子发生氧化反应,电极反应式为:4OH﹣﹣4e﹣═2H2O+O2↑,
故答案为:负;4OH﹣﹣4e﹣═2H2O+O2↑;
(2)放电时,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,所以电极反应式为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O,
故答案为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O;
(3)乙池中B极上银离子得电子发生还原反应,当乙池中B极的质量升高648g,则甲池中理论上消耗O2体积= =33.6L,
=33.6L,
故答案为:33.6;
(4)n(CH3OH)= mol,生成CO2和液态H2O时放热22.68kJ,则2molCH3OH燃烧放出的热量为2×22.68kJ×32=1451.52kJ,
mol,生成CO2和液态H2O时放热22.68kJ,则2molCH3OH燃烧放出的热量为2×22.68kJ×32=1451.52kJ,
反应的热化学方程式为2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣1451.52kJ/mol,
故答案为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣1451.52kJ/mol.
点评: 本题以甲醇为燃料综合考查了燃料电池以及化学平衡问题,为高频考点,侧重于学生的分析能力和计算能力的考查,难度不大,注意正负极上电极反应式的书写要结合电解质溶液的酸碱性,即使燃料和氧化剂相同,如果电解质溶液不同,电极反应式也不同.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
下列溶液中物质的量浓度为1mol•L﹣1的是()
A. 将40 g NaOH溶解于1 L 水中
B. 将22.4 LHCl溶于水配成1 L溶液
C. 将1 L 10 mol•L﹣1的浓盐酸与9 L水混合
D. 将10 g NaOH溶解在水中配成250 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将下列离子Na+、K+、Cu2+、H+、NO3﹣、Cl﹣、CO32﹣、OH﹣,按可能大量共存于同一溶液的情况,则分成A、B两组,而且每组中均含两种阳离子和两种阴离子,则A组 ,B组 .
用同浓度的AgNO3溶液分别与同浓度等体积的NaCl、MgCl2、AlCl3溶液反应,所用AgNO3溶液的体积比为 ;如用同浓度等体积的AgNO3溶液分别与等浓度的NaCl、MgCl2、AlCl3溶液反应,所用三种溶液的体积比为 .
(3)向一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用下图中的曲线 表示.
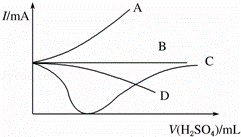
查看答案和解析>>
科目:高中化学 来源: 题型:
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是()
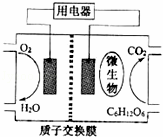
A. 该电池能够在高温下工作
B. 电池的负极反应为:C6H12O6+6H2O﹣24e﹣=6CO2↑+24H+
C. 放电过程中,H+从正极区向负极区迁移
D. 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体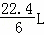
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,杠杆AB两端分别用导线挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其保持平衡,然后小心地向盛水的水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是()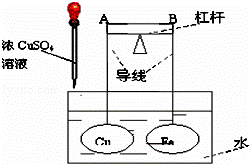
A. 杠杆为导体或绝缘体时,均为A端高B端低
B. 杠杆为导体或绝缘体时,均为A端低B端高
C. 当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
D. 当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
图表归纳是学习化学的一种常用方法,某同学表中归纳的内容与如图对应正确的是()
选项 x y z
A 胶体 混合物 淀粉溶液
B 化合物 酸性氧化物 一氧化氮
C 纯净物 化合物 液溴
D 强电解质 强酸 硫酸
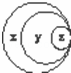
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为2Fe(OH)3+3KClO+4KOH═2K2FeO4+3KCl+5H2O,下列说法正确的是()
A. 制备高铁酸钾用ClO﹣做还原剂
B. 制备高铁酸钾时1 mol Fe(OH)3得到3 mol 电子
C. 高铁酸钾中铁的化合价为+7
D. 用高铁酸钾处理水时,其还原产物能水解产生具有强吸附能力的胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
高锰酸钾在不同的条件下发生的反应如下:
MnO4﹣+5e﹣+8H+═Mn2++4H2O①
MnO4﹣+3e﹣+2H2O═MnO2↓+4OH﹣②
MnO4﹣+e﹣═MnO42﹣(溶液绿色)③
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的酸碱性影响.
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为 ﹣→ +.
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色.下列说法正确的
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3:2,完成下列化学方程式(横线上填系数,括号内填物质):
KMnO4+ K2S+ KOH═ K2MnO4+3K2SO4+2S↓+ .
②若生成6.4g单质硫,反应过程中转移电子的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
配制100mL 1.0mol/LNa2CO3溶液,下列操作正确的是()
A. 称取10.6g无水碳酸钠,加入100mL容量瓶中,加水溶解、定容
B. 称取10.6g无水碳酸钠,加入100mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com