
| A. | 推广碳捕集和存储技术,逐步实现二氧化碳零排放 | |
| B. | 对工业废水、生活污水净化处理,减少污染物的排放 | |
| C. | 加大铅蓄电池、含汞锌锰干电池的生产,满足消费需求 | |
| D. | 加大清洁能源的开发利用,提高资源的利用率 |
分析 A.推广碳捕集和储存技术,逐步实现二氧化碳零排放,减少温室效应;
B.对工业废水、生活污水净化处理,减少污染物的排放;
C.铅酸蓄电池、含汞锌锰干电池,含有重金属,容易造成环境污染;
D.化石燃料的燃烧,能够造成环境污染.
解答 解:A.二氧化碳气体是产生温室效应的主要气体,推广碳捕集和储存技术,逐步实现二氧化碳零排放,减少了二氧化碳的排放,符合社会可持续发展理念,故A正确;
B.水污染主要来自工业、农业、生活污染物的排放,工业废水生活污水经过处理后可以节约资源,保护水源,符合社会可持续发展理念,故B正确;
C.加大铅酸蓄电池、含汞锌锰干电池的生产,废旧电池含有的铅、汞、锌、锰污染和废旧蓄电池电解液污染,会造成污染,不符合社会可持续发展理念,故C错误;
D.加大清洁能源的开发利用,提高资源的利用率,可减少化石能源的利用,符合可持续发展理念,故D正确;
故选:C.
点评 本题考查环境保护及可持续发展,明确可持续发展理念的内涵是解题关键,注意养成节能减排的品质,题目难度不大.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:填空题
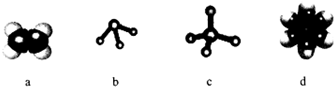
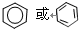 .
.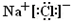 ,Na在F单质中燃烧的产物是Na2O2.
,Na在F单质中燃烧的产物是Na2O2.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 有一澄清的碱性溶液,做离子鉴定时得出的结论是含有:Al(OH)4-、Fe3+、HCO3- | |
| B. | 某一固体溶于水后,检验出含有K+、NO3-、Na+、Cl-等离子,则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物 | |
| C. | 固体NaOH吸收了空气中的二氧化碳并溶于水后,则溶液中就一定大量存在碳酸根离子 | |
| D. | 加热碳酸氢铵固体,将生成的气体通过碱石灰能制备NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
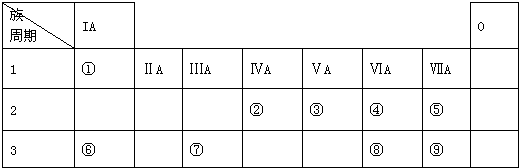
 .
.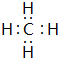
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:K+、SO42-、Cu2+、Cl- | |
| B. | 0.1mol/L 的FeCl2的溶液中:H+、Na+、NO3-、Cl- | |
| C. | 使甲基橙变红的溶液中:K+、HCO3-、Ba2+、I- | |
| D. | c(H+)/c(OH-)=1×10-12:NH4+、Cl-、Ca2+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共有4种,其中一种物质不属于羧酸 | |
| B. | 共有5种,其中一种为二元酸 | |
| C. | 共有6种,其中只有一种不是有机酸 | |
| D. | 共有6种,它们在一定条件下均能与乙醇发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 处理过程中银器一直保持恒重 | |
| B. | 食盐溶液作为电解质溶液形成原电池 | |
| C. | 银器为正极,Ag2S被还原生成单质银 | |
| D. | 黑色褪去的原因是黑色Ag2S转化为白色AgCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com