
| A、11.4g | B、16.5g |
| C、9.7g | D、8.7g |
| 3.36L |
| 22.4L/mol |
| 0.15×2 |
| (3-0) |
| 4.48L |
| 22.4L/mol |
| 3.36L |
| 22.4L/mol |
| 0.15×2 |
| (3-0) |
| 4.48L |
| 22.4L/mol |


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 二氧化硫通入品红溶液中 | 品红溶液褪色 | 二氧化硫具有还原性 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
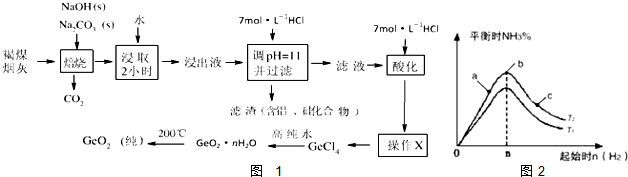
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| D | 常温下白磷可自燃,而氮气须在放电时才与氧 气反应 | 非金属性:P>N |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
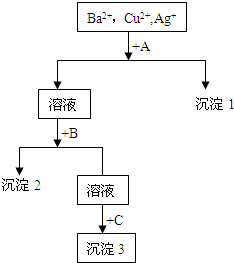 某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2CO3溶液将这三种离子逐一沉淀分离.其流程图如图所示
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2CO3溶液将这三种离子逐一沉淀分离.其流程图如图所示查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2、Na2CO3 |
| B、Na2CO3 |
| C、Na2CO3、NaOH |
| D、Na2O2、Na2CO3、NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨可用作致冷剂 |
| B、铁制容器常温下可盛装浓硫酸 |
| C、氢氧化钠可用作医用胃酸中和剂 |
| D、硅酸钠是制备木材防火剂的原料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com