


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.265mol/L |
| B、0.525mol/L |
| C、0.21mol/L |
| D、0.42mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O |
| B、向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+=BaSO4↓+NH3?H2O+H2O |
| C、从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
| D、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
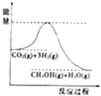 一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),该反应的能量变化如图所示:
一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),该反应的能量变化如图所示:| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电离平衡常数受溶液浓度的影响 | ||||
| B、电离常数大的酸溶液中c(H+)一定比电离常数小的酸溶液中的大 | ||||
| C、电离平衡常数可以表示弱电解质的相对强弱 | ||||
D、H2CO3的电离常数表达式:K=
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
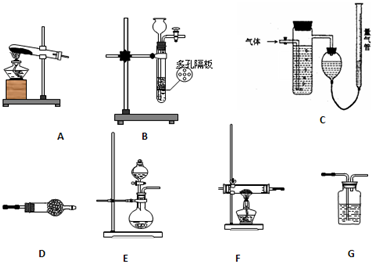 为测定氨分子中氮、氢原子个数比,某研究性学习小组用浓氨水和氧化钙反应制取氨气,然后用氨气与氧化铜粉末发生氧化还原反应.设计了如下实验流程:实验中,先检查装置气密性;然后用制得的氨气排尽洗气瓶前所有装置中的空气;再连接洗气瓶和气体测量装置;立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.
为测定氨分子中氮、氢原子个数比,某研究性学习小组用浓氨水和氧化钙反应制取氨气,然后用氨气与氧化铜粉末发生氧化还原反应.设计了如下实验流程:实验中,先检查装置气密性;然后用制得的氨气排尽洗气瓶前所有装置中的空气;再连接洗气瓶和气体测量装置;立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com