
����Ŀ����2L�ܱ������ڣ�800��ʱ��Ӧ��2NO(g)+O2(g)![]() 2NO2(g)����ϵ��n(NO2)��ʱ��ı仯�����
2NO2(g)����ϵ��n(NO2)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)(mol) | 0.00 | 0.010 | 0.012 | 0.013 | 0.013 | 0.013 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K=____________����֪��K��350����300��������÷�Ӧ��________��������ţ��ȷ�Ӧ��
��2����ͼ�б�ʾNO�ı仯��������_________������ĸ����O2��ʾ��0~2 s�ڸ÷�Ӧ��ƽ������v=_________��
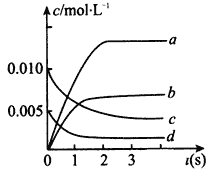
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����______________������ĸ��
A��c(NO2)=2c(O2) B��������ѹǿ���ֲ���
C��v�� (NO)=2v��(O2) D���������ܶȱ��ֲ���
���𰸡� K=![]() �� c 1.5��10-3mol��L��1��s��1 BC
�� c 1.5��10-3mol��L��1��s��1 BC
��������(1)��Ӧ2NO(g)+O2(g)2NO2(g)��ϵ�У�ƽ�ⳣ��Ϊ����Ũ��ϵ�����ݵij˻��뷴Ӧ��Ũ��ϵ�����ݵij˻��ı�ֵ��K=![]() ��K(300��)��K(350��)�������¶ȣ�K��С���������¶�ƽ�����淴Ӧ�����ƶ��������淴Ӧ�������ȣ�����Ӧ����Ϊ���ȷ�Ӧ���ʴ�Ϊ��
��K(300��)��K(350��)�������¶ȣ�K��С���������¶�ƽ�����淴Ӧ�����ƶ��������淴Ӧ�������ȣ�����Ӧ����Ϊ���ȷ�Ӧ���ʴ�Ϊ�� ![]() ���ţ�
���ţ�
(2)NO��O2�Ƿ�Ӧ�Ũ����С���ұ仯��NOΪ����Ũ�ȱ仯����2������˱�ʾNO�仯��������c��2s����NO2��ʾ��ƽ����Ӧ����v(NO2)=![]() =
=![]() =3.0��10-3molL-1s-1������֮�ȵ��ڻ�ѧ������֮�ȣ�����v(O2)=
=3.0��10-3molL-1s-1������֮�ȵ��ڻ�ѧ������֮�ȣ�����v(O2)=![]() v(NO2)=
v(NO2)=![]() ��3.0��10-3molL-1s-1=1.5��10-3molL-1s-1���ʴ�Ϊ��c��1.5��10-3molL-1s-1��
��3.0��10-3molL-1s-1=1.5��10-3molL-1s-1���ʴ�Ϊ��c��1.5��10-3molL-1s-1��
(3)A��ƽ��ʱc(NO2)��c(O2)����������й���ƽ��ʱ��һ������c(NO2)=2c(O2)������˵���ﵽƽ�⣬��A����B���淴Ӧ���У���Ӧ��������ܵ����ʵ����ڼ�С�����������ʵ������ֲ��䣬����ѹǿ���䣬˵����Ӧ����ƽ�⣬��B��ȷ��C����ͬ���ʱ�ʾ���ʣ�����ƽ��ʱ����������֮�ȵ��ڻ�ѧ������֮�ȣ�v�� (NO)��v��(O2)=2��1����v�� (NO)=2v��(O2)����C��ȷ��D�������������������䣬�����ݻ�Ϊ��ֵ�������ܶ���ʼ���ղ��䣬����˵���ﵽƽ�⣬��D���ʴ�Ϊ��BC��


 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У���ӦX2(g)��Y2(g) ![]() 2XY(g) ��H��0�ﵽ��ƽ�⡣�ڽ��ı�ijһ�����ﵽ��ƽ�⣬�Դ˹��̵�ͼ�������ȷ���ǣ� ��
2XY(g) ��H��0�ﵽ��ƽ�⡣�ڽ��ı�ijһ�����ﵽ��ƽ�⣬�Դ˹��̵�ͼ�������ȷ���ǣ� ��

A. ͼ���Ǽ����ʵ������ı仯��� B. ͼ���������¶ȵı仯���
C. ͼ��������ѹǿ�ı仯��� D. ͼ����������������ı仯���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��������һ�������Դ������Դ�����ǣ�
;��1����̫���ֽܷ�ˮ�������� ;��2���þ۽�̫���ܷ�Ӧ���������·�Ӧ��CH4(g)��H2O(g)===CO(g)��3H2(g) ��H����206 kJ��mol��1
��֪����25�桢101kPaʱ 2CO(g)+ O2 (g) ===2CO2(g) ��H����566.0 kJ��mol��1
��1����25�桢101kPaʱ��1��H2��ȫȼ��������̬ˮʱ����120.9kJ��������ȫ�÷�Ӧ���Ȼ�ѧ����ʽ��2H2��g��+O2��g��===2H2O��g����H =_________
��2����֪�����γ�1mol��ѧ����Ҫ��ͬ��������;��2�У���1mol H��H����������ckJ��1molH��O����bkJ��1mol C��H����akJ�����1mol CO(g)��ѧ����Ҫ������_______kJ ���ú���ĸ��ʽ�ӱ�ʾ��
��3��CH4ȼ������CO2����̬H2O���Ȼ�ѧ����ʽΪ__________
II������������ȼ�ϵ��Ϊ��Դ���е���ʵ��װ����ͼ��ʾ��
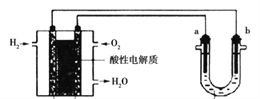
��4��ȼ�ϵ�ع���ʱ��������ӦΪ��______________��
��5��U����װCuSO4��Һʱ��a��b��������ʯī������ͬ������a���������������������ĵ�H2������ǣ�________��
��6��U����װ����NaClˮ��Һʱ������ܷ�Ӧ�����ӷ���ʽ��______________��
��7���ö��Ե缫���M��NO3��x��ˮ��Һ��������������m��ʱ����������ͬʱ����nL��������״�������Ӷ���֪M�����ԭ��������_________�����ú���ĸ��ʽ�ӱ�ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y��Z��W��ԭ������������������ͼ��ʾ����ת����ϵ�У�l���ɸ�����Ԫ����ɵ����ӻ����m��Y�ĵ��ʣ�n��Z�ĵ��ʣ�m��n��Ϊ��������Ҫ�ɷ֣�p��W�ĵ��ʣ�����Ϊ�����������ֻ�����Ԫ����ɵĻ����u��ˮ��Һ����Ư���ԣ�t��v��ΪһԪǿ�ᡣ

����˵����ȷ����
A. ����u�мȺ����ۼ��ֺ����Ӽ�
B. ���³�ѹ�£�r��s��Ϊ��ɫ����
C. ����̬�⻯������ȶ��ԣ�Z
D. X��Y��Z����Ԫ���γɻ������ˮ��Һ���ܳ����ԣ�Ҳ���ܳʼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������H2��ԭWO3�Ʊ�����W��װ����ͼ��ʾ��Zn������������������ʣ�����ûʳ������Һ������������������ KMnO4����������H2S��������˵����ȷ����

A. �١��ڡ���������ʢװKMnO4��Һ��ŨH2SO4������ûʳ������Һ
B. ��ʽ¯����ǰ�����Թ��ڢܴ��ռ����岢��ȼ��ͨ�������ж����崿��
C. ������Ӧʱ���ȹرջ���K����ֹͣ����
D. װ��Q�����շ�������Ҳ�����ڶ���������������ⷴӦ�Ʊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У���Ԫ��ȫ������������(����)
A. 2P+3Cl2![]() 2PCl3
2PCl3
B. 2NaCl(����)![]() 2Na+Cl2��
2Na+Cl2��
C. NaOH+HClNaCl+H2O
D. 2Cl2+2Ca(OH)2CaCl2+Ca(ClO)2+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.2 L��NaCl��Һ��MgCl2��Һ��CuCl2��Һ��ɵĻ����Һ�У��������ӵ�Ũ����ͼ��ʾ��
(1)���Һ�У�NaCl�����ʵ���Ϊ_______mol��MgCl2������Ϊ_______g��
(2)�û����Һ��CuCl2�����ʵ���Ũ��Ϊ_____molL��1�����û����Һ��ˮϡ�������Ϊ1 L��ϡ�ͺ���Һ��Cu2+�����ʵ���Ũ��Ϊ_______molL��1��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com