
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于 元素周期表第 周期第 族;S的基态原子核外有 个未成对电子;Si的基态原子核外电子排布式为 。
元素周期表第 周期第 族;S的基态原子核外有 个未成对电子;Si的基态原子核外电子排布式为 。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si S | O2- Na+ | NaCl Si | H2SO4 HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101KPa下,已知该反应每消耗1 m ol CuCl2(s),放热44.4KJ,该反应的热化学方程式是 。
ol CuCl2(s),放热44.4KJ,该反应的热化学方程式是 。
(4)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目 。
查看答案和解析>>
科目:高中化学 来源: 题型:
罗马大学Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子结构与白磷P4相似。已知断裂1 mol N—N键吸收167 kJ热量,生成 1 mol N≡N键放出 942 kJ 热量。由此判断下列说法正确的是
A.N4属于一种新型的化合物,分子内存在非极性键
B.N4与N2互为同位素,化学性质相似,物理性质不同
C.N4沸点比P4(白磷)高
D.1 mol N4气体转变为N2将放出882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为CnH2nO2的羧酸和某醇酯化生成分子式为Cn+2H2n+4O2的酯,反应所需羧酸和醇的质量比为1∶1,则该羧酸是( )
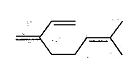 A.乙酸 B.丙酸 C.甲酸 D.乙二酸
A.乙酸 B.丙酸 C.甲酸 D.乙二酸
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是实验室制乙酸乙酯的装置。
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是_________________________________然后轻轻地振荡试管,使之混合均匀。
(2)浓硫酸的作用是______________;_____________。
(3)饱和Na2CO3溶液的作用是___________________________
;能否用NaOH溶液代替,理由是
。
(4)实验生成的乙酸乙酯,其密度比水___ (填“大”或“小”),有_____气味。
(5)若实验中温度过高,使反应温度达到140℃左右时,发生的副反应的方程式是______________________________________ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.含有共价键的化合物 一定是共价化合物
一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键形成的分子一定是共价化合物
D.只有非金属原子间才能形成共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
| T | 常温常压下,T单质是淡黄色固体,常在火山口附近沉积 |
| P | P的价层电子排布为[Ar]3d104s2 |
(1)W位于元素周期表第________周期第________族;W的原子半径比X的________(填“大”或“小”)。
(2)TY2中心原子的杂化方式为_______;XY2中一个分子周围有__________个紧邻分子;堆积方式与XY2晶胞类型相同的金属有_________(从“Cu、 Mg、K、Po”中选出正确的),其空间利用率为_______。
(3)Z的第一电离能比Mg的________(填“大”或“小”);写出Z单质与NaOH溶液反应的化学方程式 。
(4)写出W的最高价氧化物与NaOH溶液反应的离子方程式 ;W的最高价氧化物与XY2的熔点较高的是 ,原因是 。
(5)处理含XO、TO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质T。已知:
① XO(g)+ 1/2O2(g)=XO2(g) ΔH=-283.0 kJ·mol-1 ② T(s)+O2(g)=TO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是______________________________。
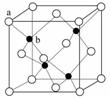
(6)P在周期表的 区;P和T形成的化合物PT在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方PT晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_________ g·cm-3(列式并计算)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com