


科目:高中化学 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①②⑤⑥ |
| C、③⑤⑥⑦ | D、①③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、刚充人时反应速率:v(正)减小,v(逆)增大 |
| B、达到新的平衡时:反应混合物中A、B的物质的量分数不变 |
| C、达到新的平衡时:c(A):c(B):c(C)仍为1:1:2 |
| D、达到新的平衡过程中:体系压强先增大,后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:3 | B、1:2 |
| C、1:1 | D、3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
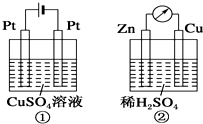 如图所示的两个装置中,溶液的体积 均为200mL,开始时电解质溶液的浓度均为0.1mol/L.工作一段时间后,测得导线中均通过0.02mol电子.若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如图所示的两个装置中,溶液的体积 均为200mL,开始时电解质溶液的浓度均为0.1mol/L.工作一段时间后,测得导线中均通过0.02mol电子.若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )| A、产生气体的体积:①>② |
| B、溶液的pH变化:①增大,②减小 |
| C、电极上析出固体物质的质量:①>② |
| D、电极反应式:①的阴极:Cu2++2e-═Cu,②的负极:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
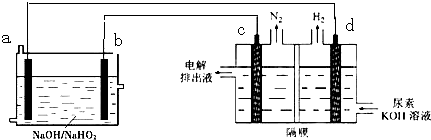
| A、燃料电池总反应为:3HO2-+2Al=OH-+2AlO2-+H2O |
| B、电极b是正极,且反应后该电极区pH增大 |
| C、每消耗27g Al,理论上产生11.2L(标准状况下)氮气 |
| D、反应时,电子的流向为:a→b→c→d. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com